题目内容
10.氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69,.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(l)△H=-97.3kJ/mol(1)若在此条件下,将化学平衡常数K减小,化学反应速率v正增大,可采取的措施是a(选填编号).
a.升高温度 b.移走SO2Cl2c.增加反应物浓度 d.无法满足上述条件
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是ac(选填编号).
a.缩小容器体积 b.使用催化剂c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有c(选填编号).
a.只有37Cl2 b.只有SO237Cl2c.37Cl2和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡状态的是bd(选填编号).
a.υ(Cl2)=υ(SO2)
b.容器中气体压强不随时间而变化
c.c(Cl2):c(SO2)=1:1
d.容器中气体颜色不随时间而变化.
分析 (1)平衡常数只受温度影响,将化学平衡常数K增大,应使平衡向正反应移动,该反应正反应是放热反应,故应降低温度,化学反应速率降低,据此解答;
(2)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,根据平衡移动原理结合选项分析解答,注意不能只增大氯气的用量;
(3)增大氯气的浓度,平衡向正反应移动,反应为可逆反应,反应物不能完全反应,平衡时37Cl存在37Cl2和SO237Cl2 中;
(4)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生其它一些物理量不变,据此结合选项判断.
解答 解:(1)平衡常数只受温度影响,将化学平衡常数K增减小,该反应正反应是放热反应,故应升高温度,化学反应速率加快,化学反应速率v正增大,故选a,故答案为:a;
(2)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,不能只增大氯气的用量,
a.缩小容器体积,压强增大,平衡向正反应移动,Cl2的转化率增大,故a正确;
b.使用催化剂,缩短到达平衡的时间,不影响平衡移动,Cl2的转化率不变,故b错误;
c.增加SO2浓度,平衡向正反应移动,Cl2的转化率增大,故c正确;
d.该反应正反应是放热反应,升高温度,平衡向逆反应移动,Cl2的转化率降低,故d错误;
故答案为:ac;
(3)增大氯气的浓度,平衡向正反应移动,反应为可逆反应,氯气不能完全反应,故平衡时37Cl存在37Cl2和SO237Cl2 中,
故答案为:c;
(4)a.υ(Cl2)=υ(SO2),没有指明正、逆速率,无法判断,故a错误;
b.随反应进行,气体的物质的量减小,压强减小,容器中气体压强不随时间而变化,说明达到平衡,故b正确;
c.平衡时氯气与二氧化硫的浓度与起始浓度有关,起始浓度不同,平衡时二者浓度不同,若二者起始浓度相同,用于二者按1:1反应,故任意时刻二者的浓度都相同,故c(Cl2):c(SO2)=1:1不能说明达到平衡,故c错误;
d.容器中气体颜色不随时间两变化,说明氯气的浓度不再变化,说明达到平衡,故d正确;
故答案为:bd.
点评 本题考查化学平衡常数、影响反应速率的因素、化学平衡状态的判断、化学平衡影响因素等,难度中等,化学平衡状态的判断可用未平衡时是变量如果不变,说明达平衡状态.

 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 高纯度的硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| B. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 |
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3$\frac{\underline{\;\;△\;\;}}{\;}$TiO2+H2O
④TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO
⑤TiCl4+2Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgCl2+Ti.
下列叙述错误是( )
| A. | 反应①属于非氧化还原反应 | |
| B. | 反应②属于非氧化迩原友应 | |
| C. | 反应④中TiO2是氧化剂 | |
| D. | 反应⑤表现了金属镁还原性比进士钛强 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 不易溶于水,易溶于苯等有机溶剂 | B. | 是芳香烃,也是苯的同系物 | ||
| C. | 能发生聚合反应,其产物可表示为 | D. | 分子中所有碳原子一定在同一平面 |
 常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)>c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
 ,它是汽油燃烧品质抗震性能的参照物,用系统命名法对它命名2,2,4-三甲基戊烷,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:
,它是汽油燃烧品质抗震性能的参照物,用系统命名法对它命名2,2,4-三甲基戊烷,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为: ;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.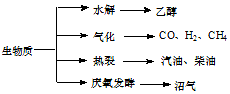 生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图.