题目内容
5.化合物A的结构简式为: ,它是汽油燃烧品质抗震性能的参照物,用系统命名法对它命名2,2,4-三甲基戊烷,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:
,它是汽油燃烧品质抗震性能的参照物,用系统命名法对它命名2,2,4-三甲基戊烷,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为: ;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
分析 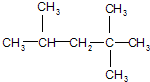 为烷烃,主链为戊烷,在2号C含有2个甲基,在3号C含有1个甲基,据此对该有机物进行命名;
为烷烃,主链为戊烷,在2号C含有2个甲基,在3号C含有1个甲基,据此对该有机物进行命名;
A的同分异构体中含等效氢原子种类最少的一种物质为2,2,3,3-四甲基丁烷;
在该烷烃的碳架上添加碳碳双键即可得到烯烃的结构简式.
解答 解: 主链五个碳,依据系统命名法得到物质的名称为:2,2,4-三甲基戊烷;
主链五个碳,依据系统命名法得到物质的名称为:2,2,4-三甲基戊烷;
A的同分异构体中含等效氢原子种类最少的一种物质为2,2,3,3-四甲基丁烷,结构简式为 ;
;
若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式可能为:CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3,
故答案为:2,2,4-三甲基戊烷; ;CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
;CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
点评 本题考查较为综合,涉及有机物的命名、结构和性质、同分异构体,侧重于学生的双基的考查,注意把握有机物的结构、性质的判断,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列有关物质的用途不正确的是( )
| A. | 高纯度的单质硅可用于制作计算机芯片 | |
| B. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| C. | 二氧化硫不可用作熏蒸粉丝 | |
| D. | 碳酸钠可用于治疗胃酸过多 |
16.某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
①已知MnO2呈弱碱性.I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是MnO2+4HCl═MnCl4+2H2O.
②II中发生了分解反应,反应的化学方程式是MnCl4═Cl2↑+MnCl2.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究如图1:

④将实验III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;
⑤将i、ii作对比,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-).
⑥用图2装置(a、b均为石墨电极)进行实验V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大氧化性越强.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸不能(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
通过实验I、II、III证明混合气体中含有Cl2,III的操作是将湿润的淀粉KI试纸伸入纯净的NO2中.
(1)研究盐酸被MnO2氧化.
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
②II中发生了分解反应,反应的化学方程式是MnCl4═Cl2↑+MnCl2.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究如图1:

④将实验III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;
⑤将i、ii作对比,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-).
⑥用图2装置(a、b均为石墨电极)进行实验V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大氧化性越强.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸不能(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
13.如图是一种新型高温可充电电池(电池的活性物质为Na和S),则下列说法中正确的是( )

| A. | 放电时,Na+由石墨b向石墨a迁移 | |
| B. | 充电时石墨b与外接电源负极相连 | |
| C. | 充电时,每有23gNa生成,固体电解质中通过1mol电子 | |
| D. | 放电时石墨b上发生的反应为:2Na++xS+2e-=Na2Sx |
20.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 在7.8gNa2O2固体中,含有阴、阳离子的总数为0.3NA | |
| B. | 光照下,将16gCH4和71gCl2组成的混合气体充分反应,生成CH3Cl分子数为NA | |
| C. | 若发生水解的Fe3+为1mol,此时生成的氢氧化铁胶粒数为NA | |
| D. | 100g质量分数为46%的乙醇水溶液中,所含氢氢原子总数为6NA |
9.设NA为阿伏伽德罗常数,下列有关说法正确的是( )
| A. | 1L 0.1mol/L 的氨水含有0.1NA个OH- | |
| B. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| C. | 1mol CH3COOC2H5在NaOH溶液中完全水解得到乙醇分子数为NA | |
| D. | 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)[与偏铝酸根相似,偏铝酸根也可以写成Al(OH)4-]Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)[与偏铝酸根相似,偏铝酸根也可以写成Al(OH)4-]Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: