题目内容
6.下列物质:①Al②Al(OH)3③Al2O3④NaHCO2其中既能和酸反应又能和碱反应的是( )| A. | ②③ | B. | ①②③ | C. | ①②③④ | D. | ②③④ |
分析 根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应.以此解答本题.
解答 解:①金属铝与盐酸反应生成铝盐(Al3+)和氢气,与氢氧化钠反应生成偏铝酸盐(AlO2-)和氢气,故①正确;
②Al(OH)3 属于两性氢氧化物,既能与酸反应,生成铝盐(Al3+),又能与碱反应生偏铝酸盐(AlO2-),故②正确;
③Al2O3属于两性氧化物,既能与酸反应,生成铝盐(Al3+),又能与碱反应生成偏铝酸盐(AlO2-),故③正确;
④NaHCO3属于多元弱酸的酸式盐,既能与盐酸反应,生成CO2气体,又能与氢氧化钠反应,生成盐,故④正确;
故选C.
点评 本题考查元素化合物的性质,题目难度不大,旨在考查学生对知识的理解识记与知识归纳,注意基础知识的积累.

练习册系列答案
相关题目
16.下列有关同分异构体数目的叙述不正确的是( )
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 与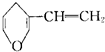 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| C. | 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种 | |
| D. | 菲的结构简式为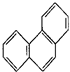 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
17.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示,关于该电池的叙述正确的是( )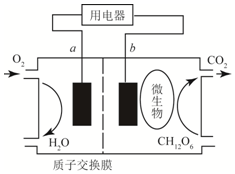

| A. | 该电池能够将电能转化为化学能 | |
| B. | b为该电池的正极 | |
| C. | 放电过程中,H+从a极区向b极区迁移 | |
| D. | 在电池反应中,正极上每消耗5.6L(标准状况下)气体时,则有NA个H通过质子交换膜 |
1.下列反应的离子方程式书写正确的是( )
| A. | 实验室用大理石和稀盐酸抽取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 氢氧化铝与盐酸反应:H++OH-═H2O | |
| C. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | NO2与水的反应:3NO2+H2O═2NO3-+2H++NO |
 某化学小组设计了铜与浓、稀硝酸反应的一体化实验装置如图所示(部分固定装置省略),实验步骤如下.请回答下列问题:
某化学小组设计了铜与浓、稀硝酸反应的一体化实验装置如图所示(部分固定装置省略),实验步骤如下.请回答下列问题: