题目内容
N元素有多种化合物,它们之间可以发生转化,如:N2H4+HNO2=2H2O+HN3.请回答下列问题:
(1)N与O电负性较大的是 .
(2)NaN3的晶体类型是 .
(3)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是 .
(4)N2H4中的N原子的杂化类型是 .
(5)NO2-离子是一种很好的配位体,能提供孤电子对是 .
A.氧原子 B.氮原子 C.两者都可以
NO2-与钴盐通过配位键形成的[Co(NO2)6]3-能与K+离子结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+离子,写出该配合物中钴离子的电子排布式 .
(1)N与O电负性较大的是
(2)NaN3的晶体类型是
(3)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是
(4)N2H4中的N原子的杂化类型是
(5)NO2-离子是一种很好的配位体,能提供孤电子对是
A.氧原子 B.氮原子 C.两者都可以
NO2-与钴盐通过配位键形成的[Co(NO2)6]3-能与K+离子结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+离子,写出该配合物中钴离子的电子排布式
考点:原子轨道杂化方式及杂化类型判断,原子核外电子排布,元素电离能、电负性的含义及应用,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:(1)同一周期元素,元素电负性随着原子序数增大而增大;
(2)根据物质的构成微粒确定晶体类型;
(3)分子晶体中如果含有氢键,会导致其沸点升高;
(4)根据价层电子对互斥理论确定原子杂化类型;
(5)配体中含有孤电子对的原子能提供孤电子对;该化合物中钴离子为Co3+,该离子核外有24个电子,且3d能级上有6个电子,根据构造原理书写其基态离子核外电子排布式.
(2)根据物质的构成微粒确定晶体类型;
(3)分子晶体中如果含有氢键,会导致其沸点升高;
(4)根据价层电子对互斥理论确定原子杂化类型;
(5)配体中含有孤电子对的原子能提供孤电子对;该化合物中钴离子为Co3+,该离子核外有24个电子,且3d能级上有6个电子,根据构造原理书写其基态离子核外电子排布式.
解答:
解:(1)同一周期元素,元素电负性随着原子序数增大而增大,所以电负性O>N,故答案为:O;
(2)NaN3的构成微粒是阴阳离子,所以其晶体类型是离子晶体,故答案为:离子晶体;
(3)HN3分子间存在氢键导致其沸点较高,故答案为:HN3分子间存在氢键;
(4)N2H4中每个N原子价层电子对个数是4且含有一个孤电子对,所以该分子中的N原子的杂化类型是sp3杂化,故答案为:sp3;
(5)NO2-离子中N原子和O原子都含有孤电子对,所以都可以提供孤电子对,该化合物中钴离子为Co3+,该离子核外有24个电子,且3d能级上有6个电子,根据构造原理知其基态离子核外电子排布式为1s2s22p63s23p63d6,
故答案为:C;1s2s22p63s23p63d6.
(2)NaN3的构成微粒是阴阳离子,所以其晶体类型是离子晶体,故答案为:离子晶体;
(3)HN3分子间存在氢键导致其沸点较高,故答案为:HN3分子间存在氢键;
(4)N2H4中每个N原子价层电子对个数是4且含有一个孤电子对,所以该分子中的N原子的杂化类型是sp3杂化,故答案为:sp3;
(5)NO2-离子中N原子和O原子都含有孤电子对,所以都可以提供孤电子对,该化合物中钴离子为Co3+,该离子核外有24个电子,且3d能级上有6个电子,根据构造原理知其基态离子核外电子排布式为1s2s22p63s23p63d6,
故答案为:C;1s2s22p63s23p63d6.
点评:本题考查较综合,涉及原子杂化方式判断、原子核外电子排布式的书写、电负性、氢键等知识点,根据元素周期律、构造原理、价层电子对互斥理论等知识点分析解答,注意:排列电子时先排列能量低,但失电子时从外到内依次失去,题目难度不大.

练习册系列答案
相关题目
常温下某气态烃与氧气混合充入一容器中,点火爆炸后又恢复到原来温度,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空,则此烃分子式为( )
| A、C2H2 |
| B、C2H6 |
| C、C3H6 |
| D、C3H8 |
能够测定分子结构和化学键的方法是( )
①质谱 ②红外光谱 ③紫外光谱 ④核磁共振谱.
①质谱 ②红外光谱 ③紫外光谱 ④核磁共振谱.
| A、①② | B、③④ | C、② | D、①④ |
假设已经发现了第121号元素,则该元素原子的电子排布式正确的是( )(注:第七周期的稀有气体元素符号假定为:Abc)
| A、[Abc]5g18s2 |
| B、[Abc]8s28p1 |
| C、[Abc]7d18s2 |
| D、[Abc]6f18s2 |
| E、[Abc]6f18s2 |
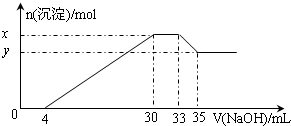 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A、原溶液中n(Mg2+):n(Al3+)=5:2 |
| B、原溶液的c(H+)=0.01 mol/L |
| C、x与y的差值为0.01 mol |
| D、原溶液中c(Cl-)=0.75mol/L |