题目内容
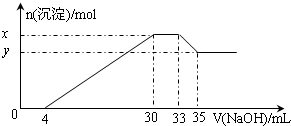 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A、原溶液中n(Mg2+):n(Al3+)=5:2 |
| B、原溶液的c(H+)=0.01 mol/L |
| C、x与y的差值为0.01 mol |
| D、原溶液中c(Cl-)=0.75mol/L |
考点:镁、铝的重要化合物,离子方程式的有关计算
专题:图示题
分析:由图象可知,开始加入氢氧化钠没有沉淀生成,0~4mL发生反应H++OH-=H2O,4mL时H+反应完毕,4~30mL发生反应Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,30mL时沉淀量最大,Mg2+、Al3+沉淀完全,30~33mL沉淀量不变,发生NH4+与氢氧化钠的反应NH4++OH-=NH3?H2O,33~35mL发生Al(OH)3与氢氧化钠的反应Al(OH)3+OH-=AlO2-+2H2O,
A.由A计算可知n[Al(OH)3],沉淀Mg2+、Al3+消耗氢氧化钠溶液26mL,根据氢氧根守恒该阶段有3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH),据此计算n[Mg(OH)2],再守恒计算原溶液中n(Mg2+):n(Al3+);
B.0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×5mol?L-1=0.02mol,计算c(H+);
C.由图象可知,x与y的差值即为Al(OH)3的物质的量,由图可知溶解Al(OH)3消耗氢氧化钠溶液5mL,据此结合方程式计算n[Al(OH)3];
D.溶液中的阴离子只有Cl-,则加入33mLNaOH溶液时Cl-全部存在于NaCl中,则n(Cl-)=n(NaOH),据此计算.
A.由A计算可知n[Al(OH)3],沉淀Mg2+、Al3+消耗氢氧化钠溶液26mL,根据氢氧根守恒该阶段有3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH),据此计算n[Mg(OH)2],再守恒计算原溶液中n(Mg2+):n(Al3+);
B.0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×5mol?L-1=0.02mol,计算c(H+);
C.由图象可知,x与y的差值即为Al(OH)3的物质的量,由图可知溶解Al(OH)3消耗氢氧化钠溶液5mL,据此结合方程式计算n[Al(OH)3];
D.溶液中的阴离子只有Cl-,则加入33mLNaOH溶液时Cl-全部存在于NaCl中,则n(Cl-)=n(NaOH),据此计算.
解答:
解:A.由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×5mol?L-1=0.01mol,即Al(OH)3的物质的量=0.01mol,则原溶液中n(Al3+)=n[Al(OH)3]=0.01mol,由图可知沉淀Mg2+、Al3+消耗氢氧化钠溶液26mL,则n(NaOH)=(30-4)mL×10-3L×5mol?L-1=0.13mol,根据氢氧根守恒该阶段有3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH),则n[Mg(OH)2]=
(0.13mol-0.01mol×3)=0.05mol,故原溶液中n(Mg2+)=0.05mol,故原溶液中n(Mg2+):n(Al3+)=5:1,故A错误;
B.0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×5mol?L-1=0.02mol,c(H+)=
=0.1mol/L,故B错误;
C.由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×5mol?L-1=0.01mol,即Al(OH)3的物质的量=0.01mol,故C正确;
D.溶液中的阴离子只有Cl-,则加入33mLNaOH溶液时Cl-全部存在于NaCl中,则Cl-的物质的量为33mL×10-3L×5mol?L-1=0.165mol,原溶液中c(Cl-)=
=0.825mol/L,故D错误;
故选C.
| 1 |
| 2 |
B.0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×5mol?L-1=0.02mol,c(H+)=
| 0.02mol |
| 0.2L |
C.由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×5mol?L-1=0.01mol,即Al(OH)3的物质的量=0.01mol,故C正确;
D.溶液中的阴离子只有Cl-,则加入33mLNaOH溶液时Cl-全部存在于NaCl中,则Cl-的物质的量为33mL×10-3L×5mol?L-1=0.165mol,原溶液中c(Cl-)=
| 0.165mol |
| 0.2L |
故选C.
点评:本题考查化学反应图象及离子反应计算,清楚图象中各阶段发生的反应是解答本题的关键,注意守恒思想的运用,难度较大.

练习册系列答案
相关题目
下列有关物质用途说法不正确的是( )
| A、氧化铝--耐火材料 |
| B、二氧化硫--食品消毒 |
| C、氧化铁--红色颜料 |
| D、二氧化硅--光导纤维 |
下列物质中,不是大气污染物的是( )
| A、NO |
| B、SO2 |
| C、H2O |
| D、可吸入颗粒物 |
导致下列现象主要与SO2的排放有关的是( )
| A、酸雨 | B、臭氧空洞 |
| C、温室效应 | D、白色污染 |
随着人们生活水平的不断提高,环保意识的增强,下列做法不科学的是( )
| A、购物时自带环保购物袋或竹篮 |
| B、大力发展清洁能源,如太阳能、氢能、风能等等 |
| C、出门尽量步行或者乘坐公交车,少开私家车 |
| D、随意丢弃废旧电池 |