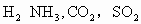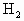题目内容
现有以下气体①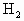 ,②
,②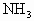 ,③CO,④
,③CO,④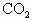 ,⑤NO,⑥
,⑤NO,⑥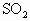 .用下图的装置(烧瓶位置不变)进行实验:
.用下图的装置(烧瓶位置不变)进行实验:
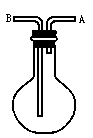
(1)若烧瓶是干燥的,从A口进气可收集________气体,从B口进气可收集________气体.
(2)若烧瓶中充满水,可收集________气体,气体应从________口进入烧瓶.
解析:
|
(1) (2)CO、NO, |

Ⅰ.A、B的起始物质的量均为2mol,
Ⅱ.C、D的起始物质的量分别为2mol和6mol.
以下说法中不正确的是( )
| A、Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同 | B、Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的平均相对分子质量相同 | C、达到平衡时,Ⅰ途径A的平衡浓度等于Ⅱ途径A的平衡浓度 | D、达到平衡时,Ⅰ途径所得混合气密度为Ⅱ途径所得混合气密度的2倍 |
工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4 、NaCl中的一种或两种杂质。现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究。实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2 、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:
1)提出假设:
假设1 白色粉末为 的混合物;
假设2 白色粉末为 的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是: 。
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(在答题卡上作答)。
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 有无色气体产生,说明样品中含有Na2CO3。 若无气体产生,说明样品中没有Na2CO3。 | |
| ② | ||
| ③ |