题目内容
2. 恒容密闭容器中发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图.下列叙述正确的是( )
恒容密闭容器中发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图.下列叙述正确的是( )| A. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| B. | T2下,在0~t1时间内v(Y)=$\frac{(a-b)}{t_1}$(mol•L-1•min-1) | |
| C. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| D. | M点时再加入一定量X,平衡后X的转化率减小 |
分析 结合图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,由此分析解答.
解答 解:A.温度越高反应速率越大,已知T1>T2,则M点的正反应速率V正大于N点的逆反应速率V逆,故A正确;
B.T2下,在0~t1时间内,X的浓度变化为:c(X)=(a-b)mol/L,则Y的浓度变化为c(Y)=$\frac{1}{2}$c(X)=$\frac{a-b}{2}$mol/L,所以T2下,在0~t1时间内v(Y)=$\frac{\frac{a-b}{2}mol/L}{{t}_{1}}$=$\frac{a-b}{2{t}_{1}}$mol•L-1•min-1,故B错误;
C.反应进行到M点时消耗的X的物质的量小于W点,由于正向是放热反应,所以反应进行到M点放出的热量M点少,即:该反应进行到M点放出的热量小于进行到W点放出的热量,故C错误;
D.如果M点时再加入一定量X,容器内气体的总物质的量增大,相当于增大了压强,平衡向着正向移动,则X的转化率增大,故D错误;
故选A.
点评 本题考查了化学平衡中浓度随时间变化的曲线分析,涉及了化学法反应速率的计算、外界条件对平衡移动影响等知识,题目难度中等,根据图象判断反应为放热反应是解题的关键,注意把握图象中曲线的变化特点,明确外界条件对化学平衡的影响.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
18.通常状况下,单斜硫和正交硫是硫的两种固态的同素异形体.已知热化学方程式:
①S(s,单斜)+O2(g)→SO2 (g)+297.16kJ
②S(s,正交)+O2(g)→SO2 (g)+296.83kJ
下列说法错误的是( )
①S(s,单斜)+O2(g)→SO2 (g)+297.16kJ
②S(s,正交)+O2(g)→SO2 (g)+296.83kJ
下列说法错误的是( )
| A. | 单斜硫比正交硫稳定 | |
| B. | 单斜硫转化为正交硫需要放出热量 | |
| C. | 单斜硫升华为气态时要吸收热量 | |
| D. | 将同态的硫单质气化或液化能提高它们的燃烧效率 |
17.在10mLpH=12的NaOH溶液中,加入10mL的某酸,再滴入石蕊试液,溶液显红色.这种酸可能是( )
| A. | pH=2的硫酸 | B. | 0.01mol/L的硝酸 | C. | 0.01mol/L的甲酸 | D. | pH=2的醋酸 |
7.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: | |
| B. | 乙烯的结构简式为CH2CH2 | |
| C. | 氯化镁的电子式: | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42ˉ |
14.X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素.X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍.下列叙述正确的是( )
| A. | 原子半径:W>R>Z | |
| B. | W的最高价氧化物对应的水化物酸性比R的强 | |
| C. | W与X形成的是离子化合物 | |
| D. | W的气态氢化物的热稳定性比Y的强 |
12.下列电离方程式中,正确的是( )
| A. | H2CO3=2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | HClO=H++Cl-+O2- |

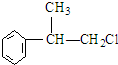 或
或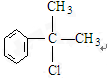 ;
;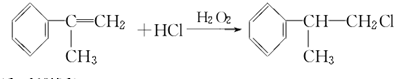 ;
; .
.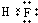 、
、 ,属于两性化合物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.
,属于两性化合物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.