题目内容
盐酸常用于清除金属表面的铜锈铁锈.某同学欲将除锈后的盐酸中的金属元素分步沉淀,查资料获知常温下水溶液中各离子沉淀的pH范围:
(1)若以离子浓度降至1×10-5mol?L-1为沉淀完全,根据上表数据推算出ksp[Fe(OH)3]= ;
(2)根据上述数据该同学设计了以下实验流程: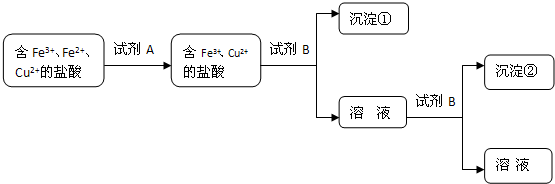
试剂A可能是 ;试剂B的化学式是 ;沉淀②化学式是 .
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.0 | 3.0 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.2 | 6.7 |
(2)根据上述数据该同学设计了以下实验流程:

试剂A可能是
考点:难溶电解质的溶解平衡及沉淀转化的本质,物质分离、提纯的实验方案设计
专题:
分析:(1)若以Fe3+离子浓度降至1×10-5mol?L-1为沉淀完全,此时pH=3.0,c(OH-)=1.0×10-11mol/L,则ksp[Fe(OH)3]=c(Fe3+)?c3(OH-)=1×10-5×(1.0×10-11)3=1.0×10-38;
(2)加入试剂A后,Fe2+消失了,则试剂A是氧化剂双氧水;加入试剂B出现了沉淀,可知试剂B是NaOH(或其它可溶性碱),调节pH:1~3,先出现红褐色沉淀氢氧化铁;当调节pH:4.2~6.7,出现Cu(OH)2.
(2)加入试剂A后,Fe2+消失了,则试剂A是氧化剂双氧水;加入试剂B出现了沉淀,可知试剂B是NaOH(或其它可溶性碱),调节pH:1~3,先出现红褐色沉淀氢氧化铁;当调节pH:4.2~6.7,出现Cu(OH)2.
解答:
解:(1)若以Fe3+离子浓度降至1×10-5mol?L-1为沉淀完全,此时pH=3.0,c(OH-)=1.0×10-11mol/L,则ksp[Fe(OH)3]=c(Fe3+)?c3(OH-)=1×10-5×(1.0×10-11)3=1.0×10-38;
故答案为:1.0×10-38;
(2)加入试剂A后,Fe2+消失了,则试剂A是氧化剂双氧水;加入试剂B出现了沉淀,可知试剂B是NaOH(或其它可溶性碱),调节pH:1~3,先出现红褐色沉淀氢氧化铁;当调节pH:4.2~6.7,出现Cu(OH)2,
故答案为:双氧水;NaOH(或其它可溶性碱);Cu(OH)2.
故答案为:1.0×10-38;
(2)加入试剂A后,Fe2+消失了,则试剂A是氧化剂双氧水;加入试剂B出现了沉淀,可知试剂B是NaOH(或其它可溶性碱),调节pH:1~3,先出现红褐色沉淀氢氧化铁;当调节pH:4.2~6.7,出现Cu(OH)2,
故答案为:双氧水;NaOH(或其它可溶性碱);Cu(OH)2.
点评:该题注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力.

练习册系列答案
相关题目
不粘锅的内壁有一薄层为聚四氟乙烯的高分子材料涂层,用不粘锅烹烧菜时不易粘锅、烧焦.下列关于聚四氟乙烯的说法正确的是( )
| A、聚四氟乙烯分子中含有双键 |
| B、聚四氟乙烯的单体是不饱和烃 |
| C、聚四氟乙烯中氟的质量分数是76% |
| D、聚四氟乙烯的化学活性较大 |
乳酸 在一定条件下自身可发生缩聚反应,生成一种高聚物
在一定条件下自身可发生缩聚反应,生成一种高聚物 ,用这种新型高聚物制成的餐具,在乳酸菌的作用下,60天内可分解成无害的物质,不会对环境造成污染.在上述聚合反应中,生成的另一种产物是( )
,用这种新型高聚物制成的餐具,在乳酸菌的作用下,60天内可分解成无害的物质,不会对环境造成污染.在上述聚合反应中,生成的另一种产物是( )
 在一定条件下自身可发生缩聚反应,生成一种高聚物
在一定条件下自身可发生缩聚反应,生成一种高聚物 ,用这种新型高聚物制成的餐具,在乳酸菌的作用下,60天内可分解成无害的物质,不会对环境造成污染.在上述聚合反应中,生成的另一种产物是( )
,用这种新型高聚物制成的餐具,在乳酸菌的作用下,60天内可分解成无害的物质,不会对环境造成污染.在上述聚合反应中,生成的另一种产物是( )| A、CO2 |
| B、C2H5OH |
| C、H2O |
| D、CH3COOH |
以下方法可用于工业冶炼金属的是( )
| A、电解熔融AlCl3获取金属铝 |
| B、电解MgCl2溶液获取金属镁 |
| C、用CO还原铁矿石来获取金属铁 |
| D、电解饱和食盐水来获取金属钠 |
光导纤维被广泛应用于光缆通讯,其主要成分是( )
| A、CuO |
| B、Fe2O3 |
| C、Al2O3 |
| D、SiO2 |
安全气囊碰撞时发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,下列判断正确的是( )
| A、每生成16 mol N2转移30 mol电子 |
| B、NaN3中N元素被氧化 |
| C、N2既是氧化剂又是还原剂 |
| D、还原产物与氧化产物质量之比为1:15 |
下列物质中具有良好导电性的是( )
| A、冰醋酸 | B、盐酸 |
| C、KCl晶体 | D、蔗糖溶液 |
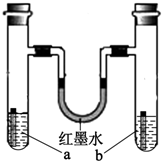 如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间.下列有关描述错误的是( )
如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间.下列有关描述错误的是( )| A、两块生铁片均发生电化学腐蚀 |
| B、墨水柱两边的液面变为左低右高 |
| C、两试管中相同的电极反应式为Fe-2e-=Fe2+ |
| D、a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |