题目内容
对于在5升的密闭容器中进行的反应:4NH3+5O2?4NO+6H2O,半分钟后,测得NO的物质的量增加0.3mol,则此反应的平均反应速率表达正确的是( )
| A、v(NO)=0.008mol/L?S |
| B、v(H2O)=0.003 mol/L?S |
| C、v(O2)=0.01mol/L?S |
| D、v(NH3)=0.004mol/L?S |
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:根据v=
计算v(NO),利用各种物质的反应速率之比等于其计量数之比计算其它气体表示的反应速率.
| ||
| △t |
解答:
解:A.在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则v(NO)=
=0.002mol/(L.s),故A错误;
B.v(H2O)=
v(NO)=0.002mol/(L.s)×
=0.003mol/(L.s),故B正确;
C.v(O2)=
v(NO)=0.002mol/(L.s)×
=0.0025mol/(L.s),故C错误;
D.v(NH3)=v(NO)=0.002mol/(L.s),故D错误,
故选B.
| ||
| 30s |
B.v(H2O)=
| 6 |
| 4 |
| 6 |
| 4 |
C.v(O2)=
| 5 |
| 4 |
| 5 |
| 4 |
D.v(NH3)=v(NO)=0.002mol/(L.s),故D错误,
故选B.
点评:本题考查化学反应速率的计算,明确反应速率之比等于化学计量数之比即可解答,题目难度不大.

练习册系列答案
相关题目
与盐酸或氢氧化钠溶液反应都能放出氢气的是( )
| A、Cu | B、Mg | C、Fe | D、Al |
下列表示物质结构的化学用语或模型正确的是( )
A、NaCl的电子式: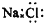 |
| B、乙烯的结构式:CH2=CH2 |
C、S2-结构示意图: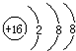 |
D、CH4分子的球棍模型: |
下列各组离子,一定能在指定环境中大量共存的是( )
| A、含有大量I-离子的溶液中:Cl?、Fe3+、Al3+、Cu2+ |
| B、使甲基橙变红的溶液中:Fe3+、Na+、SO42-、NO3- |
| C、由水电离出的c(H+)=10-12 mol?L-1的溶液中:Na+、Ba2+、AlO2-、HCO3- |
| D、加入Al能放出大量H2的溶液中:NH4+、K+、SO32?、C1? |
根据柠檬醛的结构简式: ,判断下列有关说法中不正确的是( )
,判断下列有关说法中不正确的是( )
 ,判断下列有关说法中不正确的是( )
,判断下列有关说法中不正确的是( )| A、它可以使酸性高锰酸钾溶液褪色 |
| B、它可以使溴水褪色 |
| C、它与银氨溶液发生反应生成银镜 |
| D、它的催化加氢反应产物的分子式为C10H20O |
下列物质不能以食盐为原料而生产的是( )
| A、盐酸 | B、硫酸 | C、烧碱 | D、纯碱 |
 如图是某烷分子的球棍模型图,图中大、小“球”表示两种元素的原子,“棍”表示化学键.其结构简式是( )
如图是某烷分子的球棍模型图,图中大、小“球”表示两种元素的原子,“棍”表示化学键.其结构简式是( )| A、CH3CH3 |
| B、CH3CH2CH3 |
| C、CH3CH2CH2CH3 |
| D、CH2CH3CH4 |
常温下,能被浓硝酸钝化的金属是( )
| A、Mg | B、Fe | C、Cu | D、Al |
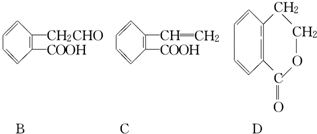
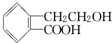 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.