题目内容
在0.1mol/L Na2CO3溶液中,各种微粒之间存在下列关系,其中不正确的是( )
| A、c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)={c(CO32-)+c(HCO3-)+c(H2CO3)} |
| C、c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:
分析:A、根据溶液中的电荷守恒来回答判断;
B、根据物料守恒来判断;
C、根据质子守恒来判断;
D、碳酸钠显示碱性,碳酸根离子存在水解平衡,据此确定离子浓度的大小关系.
B、根据物料守恒来判断;
C、根据质子守恒来判断;
D、碳酸钠显示碱性,碳酸根离子存在水解平衡,据此确定离子浓度的大小关系.
解答:
解:A、溶液中存在的电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A正确;
B、溶液中存在物料守恒c(Na+)=2{c(CO32-)+c(HCO3-)+c(H2CO3)},故B错误;
C、溶液中存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故C正确;
D、碳酸钠显示碱性,碳酸根离子存在水解平衡,定离子浓度的大小关系:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故D错误.
故选BD.
B、溶液中存在物料守恒c(Na+)=2{c(CO32-)+c(HCO3-)+c(H2CO3)},故B错误;
C、溶液中存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故C正确;
D、碳酸钠显示碱性,碳酸根离子存在水解平衡,定离子浓度的大小关系:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故D错误.
故选BD.
点评:本题考查学生电解质溶液中各种守恒思想的应用知识,注离子浓度大小关系的比较方法是重点也是难点.

练习册系列答案
相关题目
下列说法正确的是( )
| A、HClO是强酸 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、Fe在足量Cl2中燃烧只生成FeCl3 |
| D、二氧化硅是将太阳能转化为电能的常用材料 |
 已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol
已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol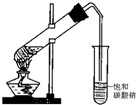

 ,此烷烃的一溴代物有
,此烷烃的一溴代物有

 三氯化铁是中学化学实验室中不可缺少的重要试剂.
三氯化铁是中学化学实验室中不可缺少的重要试剂.

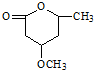 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从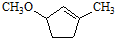 到
到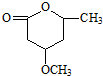 的合成路线(用合成路线流程图表示,并注明反应条件).
的合成路线(用合成路线流程图表示,并注明反应条件). …
…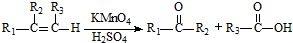 ;
;