题目内容
(16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 。
(2)工业上常用氯气与熟石灰反应制漂白粉,漂白粉的有效成分为 (填化学式)。
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是 。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);
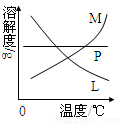
从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性 。为什么? 。
(6)若②的试管溶液中不但有KClO3生成还有KClO生成,且二者的物质的量之比为1∶2,则该反应中氧化剂和还原剂的物质的量之比为: 。
(1)MnO2+4HCl(浓) === MnCl2+Cl2↑+2H2O (2分)
(2)Ca(ClO) 2(2分)
(3) ①制取温度不同;②制取时碱的浓度也不同 (共2分)
(4) M ; 过滤(各2分)
(5)不可;石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2(各2分)
(6)7∶3(2分)
【解析】
试题分析:【解析】
(1)反应生成氯化锰、氯气和水,该反应为MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O;(2)氯气与熟石灰反应制漂白粉,反应生成氯化钙、次氯酸钙、水,有效成分为Ca(ClO) 2,故答案为:Ca(ClO) 2;(3)制取氯酸钾和次氯酸钠的条件有两个不同点:①制取温度不同;②制取时碱的浓度也不同,故答案为:①制取温度不同;②制取时碱的浓度也不同;(4)冷却后,②的试管中有大量晶体析出,则其溶解度受温度影响较大,且随温度升高而增大,则曲线M符合,固体与溶液的分离为过滤,故答案为:M;过滤;(5)因HClO具有强氧化性,所以不可证明氯气的强氧化性,因石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2,故答案为:不可;石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2;(6)有KClO3生成还有KClO生成,且二者的物质的量之比为1:2,氧化剂、还原剂均为氯气,设KClO3为xmol,KClO为2xmol,KOH为ymol,由电子守恒可知xmol×5+2x×1=(n-3x)×1,由n=10x,即还原剂为3x,氧化剂为7x,所以氧化剂和还原剂的物质的量之比为7:3,故答案为:7:3.
考点:性质实验方案的设计。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案根据反应:S2O32-+2H+==SO2+S↓+H2O,下表各组实验最快出现浑浊的是
| Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | ||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | V(mL) | ||
A | 0.1 | 5 | 0.1 | 5 | 5 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(16分)Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为 ;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式: 。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
实验步骤 | 预期现象与结论 |
步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 |
; |
步骤2: ____________________________________ ____________________________________。 |
|
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:
取少量样品溶于水, 。
 CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
 减小
减小