题目内容
20.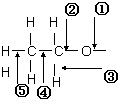 乙醇分子中各化学键如图所示:
乙醇分子中各化学键如图所示:(1)与浓硫酸共热制乙烯时,键②⑤断裂;
(2)与金属钠反应时,键①断裂,01mol乙醇与足量的钠生成0.1g氢气;
(3)催化氧化为醛时,键①③断裂;方程式2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+H2O.
分析 (1)乙醇发生消去反应生成乙烯,C-OH断裂、与羟基相连碳原子上的C-H断裂;
(2)发生反应2Na+2C2H5OH→2C2H5ONa+H2↑,根据方程式计算生成氢气的质量;
(3)乙醇的催化氧化,脱去羟基上的氢原子和与羟基相连碳原子上的氢原子;
解答 解:(1)乙醇发生消去反应生成乙烯,C-OH断裂、与羟基相连碳原子上的C-H断裂,即键②⑤断裂,故答案为:②⑤;
(2)设生成氢气的质量为x.
2Na+2C2H5OH→2C2H5ONa+H2↑
2 2
0.1mol x
$\frac{2}{0.1mol}$=$\frac{2}{x}$
x=0.1g,故答案为:0.1;
(3)乙醇的催化氧化,脱去羟基上的氢原子和与羟基相连碳原子上的氢原子,键①③断裂;方程式2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+H2O,故答案为:①③;2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+H2O.
点评 本题考查乙醇的性质,注意根据有机物的结构分析理解化学键断裂与形成,难度不大.

练习册系列答案
相关题目
3.已知10.2g A与12.8g B完全反应,生成9.6g C和7.2g D及另一气体E,已知E的密度是H2密度的15.5倍.则气体E在标准状况下的体积( )
| A. | 2.24L | B. | 4.48L | C. | 5.6L | D. | 11.2L |
11.下列分离或提纯物质的方法正确的是( )
| A. | 用渗析的方法精制Fe(OH)3胶体 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
15.下列试剂中可用于鉴别Fe2+和Fe3+的是( )
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
| A. | ①③ | B. | ①②③ | C. | ①③④ | D. | ①②③④ |
12. 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
请解释碳酸钙热分解温度最低的原因:碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果.钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低.
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3(用含a和NA的式子表示).
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3(用含a和NA的式子表示).
 新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此拳治理酒驾是因酒后驾车是引发交通事故的重要原因.如图所示为交警在对驾驶员是否饮酒进行检测.其原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+.下列对乙醇的描述与此测定原理有关的是( )
新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此拳治理酒驾是因酒后驾车是引发交通事故的重要原因.如图所示为交警在对驾驶员是否饮酒进行检测.其原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+.下列对乙醇的描述与此测定原理有关的是( ) 对于可逆反应2A(?)+B(g)?2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题:
对于可逆反应2A(?)+B(g)?2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题: .(在答题纸上标)
.(在答题纸上标)