��Ŀ����
ͼ���dz��������巢��װ�ã�IV��V��VI�������ռ�װ�ã�����Ҫ��ش��������⣺

��1������MnO2��Ũ���ᷴӦ��ȡ������Ӧѡ��װ��______���÷���ʽ��ʾ����ȡ�����ķ�Ӧԭ����______��
��2������KMnO4��Ũ���ᷴӦ��ȡ������Ӧѡ�õ�װ��______������ɲ���ƽ�������ӷ���ʽ��______MnO4-+______C1-+______H+-______Mn2++______C12��+______��
��3����ѡ��IVΪ�������ռ�װ�ã�Ӧ�����Թܿڷ���һ������������Ӧ��______��Һ��ʪ����������______��
��4����ѡ��VΪ�����ռ�װ�ã�������Ӧ��______��ͨ�룮�û�ѧ�������������ռ����˵ķ�����______��
�⣺��1���������̺�Ũ����ķ�Ӧ�ǹ�Һ��ϼ����ͣ�����ѡ���װ�ã��ڼ��������£��������̺�Ũ���ᷴӦ�����Ȼ��̡�������ˮ��
MnO2+4HC1��Ũ�� MnC12+C12��+2H2O���ʴ�Ϊ����MnO2+4HC1��Ũ��
MnC12+C12��+2H2O���ʴ�Ϊ����MnO2+4HC1��Ũ�� MnC12+C12��+2H2O��
MnC12+C12��+2H2O��
��2��KMnO4��Ũ����ķ�Ӧ�ǹ�Һ��ϲ���Ҫ���ȵģ�����Ӧѡ���װ�ã�MnO4-����Ԫ�صĻ��ϼ���+7�ۣ�Mn2+�Ļ��ϼ���+2�ۣ�����һ��MnO4-����Mn2+��5�����ӣ�����һ��C12������Ҫ2��������ʧȥ2�����ӣ����Ե�ʧ���ӵ���С��������10���ٸ���Ԫ���غ�֪���������л���ˮ�����Ը����ӷ���ʽ�еļ������ֱ�Ϊ��2��10��16��2��5��8��
�ʴ�Ϊ����2��10��16��2��5��8H2O��
��3�������ж����ݳ�����Ⱦ���������Բ����������ݳ���������ˮ�ܷ�Ӧ������ʹ����ᣬ����ʹ��������ᣬ���ܺͼӦ�����Կ�������������Һ����������
�ʴ�Ϊ���������ƣ���ֹ�����ݳ���Ⱦ������
��4���������ܶȴ��ڿ������ܶȣ�����Ӧ���������ſ������ռ���������AΪ�����ڣ������������Դ��ڵ�������ԣ������������û����⻯���еĵ⣬�ҵ������۱���ɫ�����Կ���ʪ��ĵ���KI��ֽ�����Ƿ��ռ�����������
�ʴ�Ϊ��A����ʪ��ĵ���KI��ֽ����B�ڴ�����ֽ����ɫ��֤�������Ѽ�����
��������1�����ݷ�Ӧ���״̬����Ӧ����ȷ����Ӧװ�ã��������̺�Ũ���ᷴӦ�����Ȼ��̡�������ˮ��ע��������̺�Ũ���ᷴӦ��ϡ�����Ӧ��
��2�����ݷ�Ӧ���״̬����Ӧ����ȷ����Ӧװ�ã�����������ԭ��Ӧ�е�ʧ���������ƽ����ʽ��
��3����������������ȷ���ռ�������ע�������ж�������ʹ�����ݳ���Ⱦ������
��4�������������ܶ�ѡ���ſ����ķ����������������Դ��ڵ�������ԣ��������۱���ɫ��
���������⿼����������ʵ�����Ʒ������ӷ���ʽ����ƽ������ļ����֪ʶ�㣬�ѶȲ���ע����ݷ�Ӧ���״̬����Ӧ����ѡ����Ӧ��װ�ã�
MnO2+4HC1��Ũ��
 MnC12+C12��+2H2O���ʴ�Ϊ����MnO2+4HC1��Ũ��
MnC12+C12��+2H2O���ʴ�Ϊ����MnO2+4HC1��Ũ�� MnC12+C12��+2H2O��
MnC12+C12��+2H2O����2��KMnO4��Ũ����ķ�Ӧ�ǹ�Һ��ϲ���Ҫ���ȵģ�����Ӧѡ���װ�ã�MnO4-����Ԫ�صĻ��ϼ���+7�ۣ�Mn2+�Ļ��ϼ���+2�ۣ�����һ��MnO4-����Mn2+��5�����ӣ�����һ��C12������Ҫ2��������ʧȥ2�����ӣ����Ե�ʧ���ӵ���С��������10���ٸ���Ԫ���غ�֪���������л���ˮ�����Ը����ӷ���ʽ�еļ������ֱ�Ϊ��2��10��16��2��5��8��
�ʴ�Ϊ����2��10��16��2��5��8H2O��
��3�������ж����ݳ�����Ⱦ���������Բ����������ݳ���������ˮ�ܷ�Ӧ������ʹ����ᣬ����ʹ��������ᣬ���ܺͼӦ�����Կ�������������Һ����������
�ʴ�Ϊ���������ƣ���ֹ�����ݳ���Ⱦ������
��4���������ܶȴ��ڿ������ܶȣ�����Ӧ���������ſ������ռ���������AΪ�����ڣ������������Դ��ڵ�������ԣ������������û����⻯���еĵ⣬�ҵ������۱���ɫ�����Կ���ʪ��ĵ���KI��ֽ�����Ƿ��ռ�����������
�ʴ�Ϊ��A����ʪ��ĵ���KI��ֽ����B�ڴ�����ֽ����ɫ��֤�������Ѽ�����
��������1�����ݷ�Ӧ���״̬����Ӧ����ȷ����Ӧװ�ã��������̺�Ũ���ᷴӦ�����Ȼ��̡�������ˮ��ע��������̺�Ũ���ᷴӦ��ϡ�����Ӧ��
��2�����ݷ�Ӧ���״̬����Ӧ����ȷ����Ӧװ�ã�����������ԭ��Ӧ�е�ʧ���������ƽ����ʽ��
��3����������������ȷ���ռ�������ע�������ж�������ʹ�����ݳ���Ⱦ������
��4�������������ܶ�ѡ���ſ����ķ����������������Դ��ڵ�������ԣ��������۱���ɫ��
���������⿼����������ʵ�����Ʒ������ӷ���ʽ����ƽ������ļ����֪ʶ�㣬�ѶȲ���ע����ݷ�Ӧ���״̬����Ӧ����ѡ����Ӧ��װ�ã�

��ϰ��ϵ�д�
�����Ŀ
 A������ѡѧ����ѧ�������������
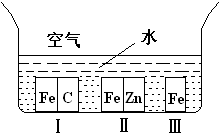
A������ѡѧ����ѧ���������������1������ͼ��ʾ�������ڢ����ֲ�ͬ�Ļ����У�������ʴ�������ɴ�С��˳����
��2�����ȴ�����һ���ƻ�����������ʣ��ڴ���ƽ�����У����ȴ����������ߵ�����ֽ����ԭ�ӣ���ԭ�Ӳ��������йط�Ӧ��
��Cl+O3��ClO+O2����O3��O+O2����ClO��Cl+O2
���з�Ӧ���ܷ�Ӧʽ��
��3��̼�������dz��������ɼ�����Ҫ����Ϊ���ڼ��������²��������壬ʹʳƷ������ɣ���д��̼���������ȷֽ�Ļ�ѧ����ʽ
��4��������Դ���ķ�����
A������ B������ C���ѷʷ� D��������շ�
B����ѡѧ����ѧ��Ӧԭ������������
�跴Ӧ��Fe��s��+CO2��g���TFeO��s��+CO��g����ƽ�ⳣ��ΪK1����Ӧ��Fe��s��+H2O��g���TFeO��s��+H2��g����ƽ�ⳣ��K2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
��2�����з�Ӧ��CO2��g��+H2��g���TCO��g��+H2O��g��д���÷�Ӧ��ƽ�ⳣ��K3����ѧ����ʽ��K3�T
��3����д�Ȼ�ѧ����ʽ��
��1mol N2��g��������O2��g����Ӧ������NO2��g��������68KJ������
��NH3��g��ȼ������NO2��g����H2O��g������֪
��1��2H2��g��+O2��g���T2H2O��g����H�T-483.6kJ/mol
��2��N2��g��+2O2��g���T2NO2��g����H�T+67.8kJ/mol
1��N2��g��+3H2��g���T2NH3��g����H�T-92.0kJ/mol
NH3��g��ȼ������NO2��g����H2O ��g���Ȼ�ѧ����ʽ��
 A��B��C��D��E��F�������ʵ�ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ���δ�������
A��B��C��D��E��F�������ʵ�ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ���δ�������
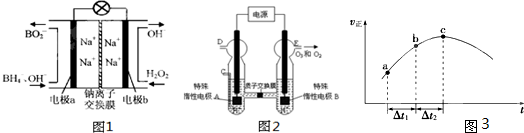
 A��B��C��D��E��F�������ʵ��ת����ϵ��ͼ��ʾ����Ӧ����δ����������з�Ӧ�����û���Ӧ��
A��B��C��D��E��F�������ʵ��ת����ϵ��ͼ��ʾ����Ӧ����δ����������з�Ӧ�����û���Ӧ�� Si+2CO��
Si+2CO��
 +Br2
+Br2 +HBr
+HBr ���ͱ�ͪ��CH3COCH3���������������£�
���ͱ�ͪ��CH3COCH3���������������£�
 +
+
