题目内容
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g).
(1)每消耗8gCH4转移mol电子.
(2)已知:①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1
③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1
④CH4(g)+2H2O(g)CO(g)+3H2(g)△H4
由此计算△H4=kJmol﹣1 .
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g) 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1
①0~tmin内,该反应的平衡反应速率v(H2)= .
②T℃时,该反应的平衡常数K= .
③当温度升高到(T+100)℃时,容器中c(CO)=0.75molL﹣1 , 则该反应是反应(填“吸热”或“放热”).
(4)一种熔融碳酸盐燃料电池的工作原理示意图如图: ①该放电过程中K+和Na+向电极(填“A”或“B”)移动.
②该电池的负极反应式为 . 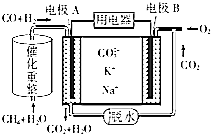
【答案】
(1)3
(2)c+3b﹣2a
(3)![]() mol/(L?min);6.75;吸热
mol/(L?min);6.75;吸热
(4)B;3H2+CO+4CO32﹣﹣8e﹣=3H2O+5CO2
【解析】解:(1)8gCH4的物质的量为n= ![]() =
= ![]() =0.5mol,CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g),反应中C元素化合价由﹣4价升高为+2价,化合价总共升高6价,该反应中转移6e﹣ , 则0.5molCH4反应转移3mol电子,所以答案是:3;(2)①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1根据盖斯定律可知:③+②×3﹣①×2,得到④CH4(g)+2H2O(g)CO(g)+3H2(g)所以△H4=(c+3b﹣2a)kJmol﹣1 , 所以答案是:c+3b﹣2a;(3)①向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g),反应开始c(CH4)=1molL﹣1 , 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1 , v(CH4)=
=0.5mol,CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g),反应中C元素化合价由﹣4价升高为+2价,化合价总共升高6价,该反应中转移6e﹣ , 则0.5molCH4反应转移3mol电子,所以答案是:3;(2)①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1根据盖斯定律可知:③+②×3﹣①×2,得到④CH4(g)+2H2O(g)CO(g)+3H2(g)所以△H4=(c+3b﹣2a)kJmol﹣1 , 所以答案是:c+3b﹣2a;(3)①向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g),反应开始c(CH4)=1molL﹣1 , 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1 , v(CH4)= ![]() =
= ![]() mol/(Lmin),速率之比等于化学计量数之比,则v(H2)=3v(CH4)=3×
mol/(Lmin),速率之比等于化学计量数之比,则v(H2)=3v(CH4)=3× ![]() mol/(Lmin)=
mol/(Lmin)= ![]() mol/(Lmin), 所以答案是:
mol/(Lmin), 所以答案是: ![]() mol/(Lmin);
mol/(Lmin);
②T℃时,1L恒容密闭容器中
CH4(g)+ | H2O | CO(g)+ | 3H2(g) | |
起始量(mol): | 1 | 1 | 0 | 0 |
变化量(mol): | 0.5 | 0.5 | 0.5 | 1.5 |
平衡量(mol): | 0.5 | 0.5 | 0.5 | 1.5 |
平衡常数K= ![]() =
=  =
= ![]() =6.75,
=6.75,
所以答案是:6.75;③升高温度平衡向吸热的方向移动,T℃时,容器中c(CO)=0.5molL﹣1 , 当温度升高到(T+100)℃时,容器中c(CO)=0.75molL﹣1 , CO浓度增多,平衡向正反应方向移动,所以正反应为吸热反应,所以答案是:吸热;(4)①原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,电池工作时,阳离子向正极移动,B为正极,即K+和Na+向电极B移动,所以答案是:B;②甲烷和水蒸气反应CH4+2H2OCO+3H2 , 原电池工作时,A为负极,负极上CO和H2失电子发生了氧化反应,CO和H2被氧化生成二氧化碳和水,电极反应为:3H2+CO+4CO32﹣﹣8e﹣=3H2O+5CO2 , B为正极,正极为氧气得电子生成CO32﹣ , 反应为2O2+4CO2+8e﹣=4CO32﹣ , 所以答案是:3H2+CO+4CO32﹣﹣8e﹣=3H2O+5CO2 .
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案