题目内容
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
(1)在 上称出相应质量的硫酸钠固体,把它放在 中,用适量的蒸馏水使它完全溶解.
(2)把制得的溶液小心地注入 中
(3)继续向 中加蒸馏水至液面距刻度1cm~2cm处,改用 小心滴加蒸馏水至溶液凹面底部与刻度线相切.
(4)用少量蒸馏水洗 和 2-3次,每次洗涤的液体都小心转入 中.
(5)将瓶塞塞紧,充分摇匀.
①请在空白处填写仪器名称
②需要称取硫酸钠固体 克
③操作步骤的正确顺序为(填序号) .
④若没有进行操作步骤④,所配溶液浓度将会 (填“偏高”、“偏低”、“无影响”)
⑤某同学定容时俯视,对所配溶液浓度的影响:会 (填“偏高”、“偏低”、“无影响”).
⑥取上述溶液100mL稀释至1000mL,所得溶液中Na+物质的量浓度为 .
(1)在
(2)把制得的溶液小心地注入
(3)继续向
(4)用少量蒸馏水洗
(5)将瓶塞塞紧,充分摇匀.
①请在空白处填写仪器名称
②需要称取硫酸钠固体
③操作步骤的正确顺序为(填序号)
④若没有进行操作步骤④,所配溶液浓度将会
⑤某同学定容时俯视,对所配溶液浓度的影响:会
⑥取上述溶液100mL稀释至1000mL,所得溶液中Na+物质的量浓度为
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据实验操作选择合适的仪器;
(2)根据容量瓶的作用来回答;
(3)胶头滴管来定容;
(4)试验中,保证溶质全部进入容量瓶,一定要洗涤烧杯和玻璃棒,并将洗涤液移入容量瓶;
(5)②根据m=nM=cVM来计算质量;
③根据实验操作的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作来回答;
④根据c=
分析操作对所配溶液浓度的影响;
⑤根据c=
分析操作对所配溶液浓度的影响;
⑥溶液100mL稀释至1000mL,所得溶液中Na+物质的量浓度是原来的十分之一.
(2)根据容量瓶的作用来回答;
(3)胶头滴管来定容;
(4)试验中,保证溶质全部进入容量瓶,一定要洗涤烧杯和玻璃棒,并将洗涤液移入容量瓶;
(5)②根据m=nM=cVM来计算质量;
③根据实验操作的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作来回答;
④根据c=
| n |
| V |
⑤根据c=
| n |
| V |
⑥溶液100mL稀释至1000mL,所得溶液中Na+物质的量浓度是原来的十分之一.
解答:
解:(1)用天平称出硫酸钠固体,放在烧杯中,用适量的蒸馏水使它完全溶解,故答案为:天平;烧杯;
(2)制得的溶液小心地注入量瓶中来定容,故答案为:容量瓶;
(3)继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改胶头滴管来定容,故答案为:容量瓶;胶头滴管;
(4)试验中,保证溶质全部进入容量瓶,一定要洗涤烧杯和玻璃棒,并将洗涤液移入容量瓶,故答案为:烧杯;玻璃棒;容量瓶;
(5)②m=nM=cVM=0.5L×0.2mol/L×142g/mol=14.2g,故答案为:14.2;
③实验操作的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,操作步骤的正确顺序为①②④③⑤,故答案为:①②④③⑤;
④若没有进行操作步骤④,则n减小,根据c=
,所配溶液浓度将会偏低,故答案为:偏低;
⑤定容时俯视,则V减小,根据c=
,所配溶液浓度偏高,故答案为:偏高;
⑥0.2mol/L的Na2SO4溶液中钠离子浓度是0.4mol/L,将溶液100mL稀释至1000mL,所得溶液中Na+物质的量浓度是原来的十分之一,即为0.04mol/L,故答案为:0.04mol/L.
(2)制得的溶液小心地注入量瓶中来定容,故答案为:容量瓶;
(3)继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改胶头滴管来定容,故答案为:容量瓶;胶头滴管;
(4)试验中,保证溶质全部进入容量瓶,一定要洗涤烧杯和玻璃棒,并将洗涤液移入容量瓶,故答案为:烧杯;玻璃棒;容量瓶;
(5)②m=nM=cVM=0.5L×0.2mol/L×142g/mol=14.2g,故答案为:14.2;
③实验操作的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,操作步骤的正确顺序为①②④③⑤,故答案为:①②④③⑤;
④若没有进行操作步骤④,则n减小,根据c=
| n |
| V |
⑤定容时俯视,则V减小,根据c=
| n |
| V |
⑥0.2mol/L的Na2SO4溶液中钠离子浓度是0.4mol/L,将溶液100mL稀释至1000mL,所得溶液中Na+物质的量浓度是原来的十分之一,即为0.04mol/L,故答案为:0.04mol/L.
点评:本题考查一定物质的量浓度溶液的配制,难度中等,注意根据c=
理解溶液的配制与误差分析等.
| n |
| V |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
化学概念是对化学现象与事实的总结和概括.下列说法中正确的是( )
| A、分散系只包括溶液和胶体 |
| B、丁达尔效应是光线通过胶体时能看到光亮的“通路”的现象 |
| C、单位物质的量的物质所具有的质量叫摩尔质量,摩尔质量与l mol物质的质量完全相同 |
| D、物质失电子的反应为还原反应 |
在一定温度下,一固定容积的密闭容器中,反应 2NO2(g)?N2O4(g)达到平衡的标志是( )
| A、化学反应速率 |
| B、混合气体的密度保持不变 |
| C、混合气体的颜色保持不变 |
| D、混合气体的体积保持不变 |
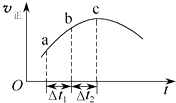 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A、反应物的总能量低于生成物的总能量 |
| B、反应物浓度:a点小于b点 |
| C、△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
| D、反应在c点达到平衡状态 |
下列各组溶液,不用其他试剂就不能鉴别的是( )
| A、FeC13、NaNO3、Na2CO3、NaC1 |
| B、NaOH、MgSO4、Na2CO3、NaHSO4 |
| C、AgNO3、KNO3、KC1、NaBr |
| D、HC1、BaC12、NaOH、CuSO4 |
将氯化钠、乙醇、碘分别从以下三种混合物中分离出来,①食盐水②乙醇溶液③碘水( )
| A、蒸发、蒸馏、萃取 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸馏、萃取、蒸发 |

