题目内容
14.写出H2O2在Fe3+催化下发生分解反应的化学方程式并标出电子转移的方向和数目 .
.
分析 2H2O2$\frac{\underline{\;Fe_{3}+\;}}{\;}$2H2O+O2↑,氧元素的化合价从-1价降为-2价,还有的从-1价升高到了0价,电子转移数=化合价升高数=化合价降低数=2,据此来表示电子转移情况.
解答 解:反应2H2O2$\frac{\underline{\;Fe_{3}+\;}}{\;}$2H2O+O2↑中,氧元素的化合价从-1价降为-2价,还有的从-1价升高到了0价,电子转移数=化合价升高数=化合价降低数=2,电子移情况如下:
故答案为: .
.
点评 本题考查了氧化还原反应中电子转移的方向和数目,题目难度不大,注意掌握化合价的变化来分析.

练习册系列答案
相关题目
4.由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
(1)①该电池的电极反应式,正极为3O2+6H2O-12e-=12OH-,负极为2CH4O+16OH--12e-=2CO32-+12H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为0.1mol.
(1)①该电池的电极反应式,正极为3O2+6H2O-12e-=12OH-,负极为2CH4O+16OH--12e-=2CO32-+12H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
5.下列各组物质可以直接通过分液进行分离的是( )
①苯和水
②乙酸乙酯和乙醇
③乙酸乙酯和纯碱溶液
④苯和溴苯
⑤硝基苯和水.
①苯和水
②乙酸乙酯和乙醇
③乙酸乙酯和纯碱溶液
④苯和溴苯
⑤硝基苯和水.
| A. | ①③⑤ | B. | ①④⑤ | C. | ①②③ | D. | ②③⑤ |
2.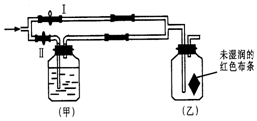 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
①浓H2SO4②饱和NaCl溶液 ③浓NaOH溶液 ④石灰水.
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( ) ①浓H2SO4②饱和NaCl溶液 ③浓NaOH溶液 ④石灰水.
| A. | ① | B. | ②③④ | C. | ①③④ | D. | ③④ |
9.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应:OH-+H+═H2O | |
| B. | 向澄清的石灰水中通入过量的CO2:OH-+CO2═HCO3- | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 金属钠与硫酸铜反应:2Na+Cu2+═2Na++Cu |
19.某原电池总反应离子方程式为2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 | |
| C. | 正极为Fe,负极为Cu,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Zn,电解质溶液为CuSO4溶液 |
6.工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO2,为便于监控,实施环境保护,下列适合测定硫酸尾气中SO2含量的试剂是( )
| A. | 品红溶液 | B. | 浓硝酸 | C. | 碘水、淀粉溶液 | D. | 以上都能 |
10.将1mol N2和3mol H2置于1L密闭容器中,在一定条件下发生反应N2+3H2═2NH3(正反应是放热反应),经过40min,该反应达到平衡时,容器中NH3的物质的量为0.4mol.则下列说法正确的是( )
| A. | 该反应在40 min内的平均速率可表示为 ν(NH3)=0.001 mol/L•min | |
| B. | 该反应达到平衡时,保持其他条件不变,容器中NH3、N2、H2的物质的量保持相等 | |
| C. | 其他条件不变,升高温度,可使该反应的速率加快 | |
| D. | 达到平衡时,ν(NH3)=ν(N2) |