题目内容
3.现有某气体分子式为AB,其摩尔质量为Mg•mol-1,取该气体VL (标准状况) 完全溶于1L水中形成密度为dg/cm3的溶液,则溶液的物质的量浓度为$\frac{1000dV}{22400+MV}$L•mol-1.分析 根据物质的量浓度为c=$\frac{1000ρw}{M}$进行计算,由此分析解答.
解答 解:w=$\frac{\frac{VL}{22.4L/mol}×Mg•mo{l}^{-}}{1000+\frac{V}{22.4}×Mg}×100%$=$\frac{MV}{22400+MV}$×100%,所以溶液的物质的量浓度为$\frac{1000d×\frac{MV}{22400+MV}}{M}$=$\frac{1000dV}{22400+MV}$mol/L,故答案为:$\frac{1000dV}{22400+MV}$.
点评 本题考查常用化学计量的计算等,难度不大,注意对公式的理解与灵活运用,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.在0.1mol•L-1的硫酸铵溶液中,下列关系正确的是( )
| A. | 2[SO42-]=[NH4+]>[H+]=[OH-] | B. | [SO42-]>[NH4+]]>[H+]=[OH-] | ||
| C. | [NH4+]]>[SO42-]>c(OH-)>c(H+) | D. | [NH4+]]>[SO42-]>[H+]>[OH-] |
11.下列有关反应离子方程式的书写中,正确的是( )
| A. | 向浓氢氧化钠溶液中通入少量的CO2气体:CO2+OH-═HCO3- | |
| B. | 过量的NaHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 向Na2S2O3溶液中通入过量的氯气:S2O32-+2Cl-+3H2O═2SO32-+4Cl-+6H+ |
18.下列物质属于电解质的是( )
①氢氧化钾 ②硫酸钡 ③铜 ④蔗糖⑤氨气 ⑥稀硫酸 ⑦熔融的KNO3.
①氢氧化钾 ②硫酸钡 ③铜 ④蔗糖⑤氨气 ⑥稀硫酸 ⑦熔融的KNO3.
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ①⑥⑦ | D. | ①⑤⑥ |
8.下列反应中,H2O作氧化剂的是( )
| A. | 2Na2O2+2H2O=4NaOH+O2↑ | B. | 2F2+2H2O=4HF+O2 | ||
| C. | 3NO2+H2O=NO+2HNO3 | D. | 3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4H2+Fe3O4 |
1.某学习小组利用如图1装置进行CO2与饱和NaCO3溶液反应制备NaHCO3实验
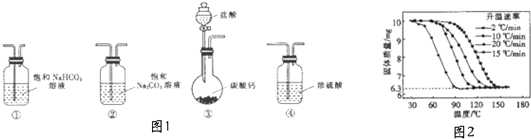
(1)选取必要的实验装置,正确的连接顺序为③①②(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2观察现象.
丙方案:测定PH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCL2溶液等
体积混合进行实验,结果如下.
(Ⅰ)此实验巳可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.答:Q=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.[已知:0.1mol•L-1NaHC03溶液电离出的c(CO32-)为0.0011mol•L-1,Ksp(BaCO3)=5.1×10-9]
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案是取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH.
④进行丁方案实验,测得样品在不同升温速率下的热重曲线如图2.请填空:
(Ⅰ)样品的纯度为100%.
(Ⅱ)升温速率对实验结果没有(填“有较大”、“有较小”或“没有”)影响.

(1)选取必要的实验装置,正确的连接顺序为③①②(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2观察现象.
丙方案:测定PH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCL2溶液等
体积混合进行实验,结果如下.
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案是取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH.
④进行丁方案实验,测得样品在不同升温速率下的热重曲线如图2.请填空:
(Ⅰ)样品的纯度为100%.
(Ⅱ)升温速率对实验结果没有(填“有较大”、“有较小”或“没有”)影响.
19.青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺如图所示.
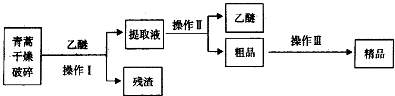
请回答下列问题:
(1)操作Ⅱ的名称是蒸馏.
(2)操作Ⅲ的主要过程可能是B(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.
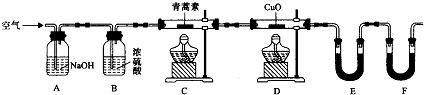
①装置E中盛放的物质是CaCl2或P2O5,装置F中盛放的物质是碱石灰.装置D的作用是使生成的CO转化成CO2而被吸收.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是在装置F后连接一个防止空气中的CO₂和水蒸气进入F的装置.
③用合理改进后的装置进行试验,称得:
则测得青蒿素的最简式是C15H22O5.
(4)充分燃烧后还需缓缓通入空气数分钟的目的是使生成的CO2和水蒸气全部赶到装置E和装置F中被完全吸收.

请回答下列问题:
(1)操作Ⅱ的名称是蒸馏.
(2)操作Ⅲ的主要过程可能是B(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.

①装置E中盛放的物质是CaCl2或P2O5,装置F中盛放的物质是碱石灰.装置D的作用是使生成的CO转化成CO2而被吸收.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是在装置F后连接一个防止空气中的CO₂和水蒸气进入F的装置.
③用合理改进后的装置进行试验,称得:
| 装置 | 实验前/g | 试验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(4)充分燃烧后还需缓缓通入空气数分钟的目的是使生成的CO2和水蒸气全部赶到装置E和装置F中被完全吸收.
 .
.