题目内容
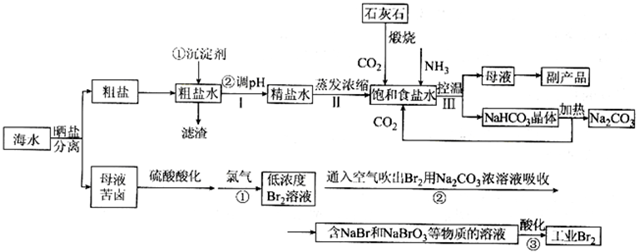
14.如图中每方框表示有关的一种反应物或生成物,方框中的字母是有关主要反应物或生成物的代码,其中C、E、G、I、X常温常压下是气体.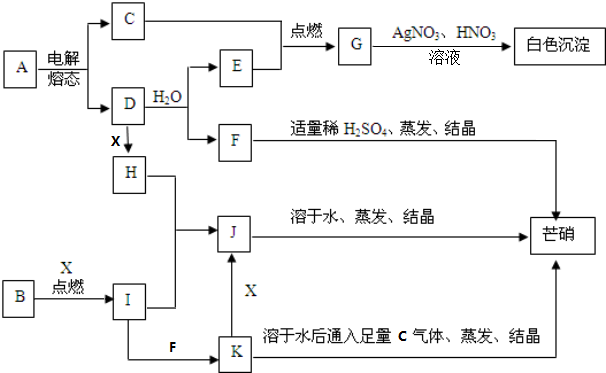
(1)B的化学式为S;H的电子式为
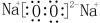 .
.(2)写出A的电解方程式2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
(3)写出固体H和气体I反应生成J的化学方程式,并注明电子转移的方向和数目
 .
.(4)将C气体通入K溶液后,溶液的pH将会降低(填升高、降低或不变),写出该反应的离子方程式SO32-+Cl2+2H2O=SO42-+2Cl-+4H+.
(5)写出D和水反应的离子方程式2Na+2H2O═2Na++H2↑+2OH-.
分析 C、E、G、I常温常压下是气体,根据题中各物质转化关系,C、E点燃生成G,G与硝酸酸化的硝酸银反应生成白色沉淀,则可推知G为HCl,C、E为H2、Cl2,E由D与水反应得到,所以E为H2,则C为Cl2,芒硝的主要成份为硫酸钠,所以可推知D为Na,F为NaOH,则A为NaCl,J溶于水蒸发结晶得芒硝,所以J为Na2SO4,K中通入氯气,蒸发结晶也能得到硫酸钠,则K为Na2SO3,K与氧气反应生成J,所以X为O2,根据B在X中燃烧生成I,I与H生成J,及I可以生成K可推知,B为S,I为SO2,H为Na2O2,以此解答该题.
解答 解:C、E、G、I常温常压下是气体,根据题中各物质转化关系,C、E点燃生成G,G与硝酸酸化的硝酸银反应生成白色沉淀,则可推知G为HCl,C、E为H2、Cl2,E由D与水反应得到,所以E为H2,则C为Cl2,芒硝的主要成份为硫酸钠,所以可推知D为Na,F为NaOH,则A为NaCl,J溶于水蒸发结晶得芒硝,所以J为Na2SO4,K中通入氯气,蒸发结晶也能得到硫酸钠,则K为Na2SO3,K与氧气反应生成J,所以X为O2,根据B在X中燃烧生成I,I与H生成J,及I可以生成K可推知,B为S,I为SO2,H为Na2O2,
(1)由以上分析可知B为S,H为Na2O2,电子式为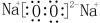 ,故答案为:S;
,故答案为:S;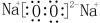 ;
;
(2)A为NaCl,电解生成钠和氯气,方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,故答案为:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑;
(3)Na2O2和气体SO2反应生成Na2SO4的化学方程式,并注明电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(4)将Cl2通入Na2SO3溶液后,发生氧化还原反应生成硫酸钠和盐酸,所以溶液的pH将会降低,反应的离子方程式为SO32-+Cl2+2H2O=SO42-+2Cl-+4H+,
故答案为:降低;SO32-+Cl2+2H2O=SO42-+2Cl-+4H+;
(5)钠和水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O═2Na++H2↑+2OH-,故答案为:2Na+2H2O═2Na++H2↑+2OH-.
点评 本题以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语与氧化还原反应等,难度较大,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,注意信息中特殊的性质与现象及特殊的转化关系是推断的关键.

 同步奥数系列答案
同步奥数系列答案已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.

②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2-t4内 c(N2)的变化曲线.
| A. | X是SO2,它既有氧化性又有还原性 | |
| B. | 干燥的气体Y不能使干燥的有色布条褪色,其水溶液具有漂泊作用的是HClO | |
| C. | Z与水反应的化学方程式为:3NO2+H2O=2HNO3+NO | |
| D. | 等物质的量的X与Y同时通入到湿润的有色布条上,有色布条褪色时间变短,漂泊效果增强 |
| A. | 丙烯与HBr加成得到的两种产物,无论通过核磁共振氢谱的吸收峰个数、还是峰面积之比,都可以进行区分 | |
| B. | 实验室制乙炔并探究其性质,需首先通过氢氧化钠,以去除去其中混有的硫化氢、磷化氢等酸性气体 | |
| C. | 利用溴乙烷的消去反应来制乙烯,并探究乙烯与高酸钾溶液反应的情况,需先通过水,防止其中可能混有的乙醇蒸汽干扰 | |
| D. | 乙酸、乙醇酯化反应实验:①使用浓硫酸做催化剂、吸水剂,②加热,及时蒸出乙酸乙酯,③适当过量的乙醇,都是在实验室条件下提高乙酸乙酯产率的方法 |
| A. | 使用催化剂或缩小容器体积,该平衡均不会移动 | |
| B. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 该可逆反应达平衡后,放出a kJ的热能(假设化学能全转化为热能) |
| A. | 煤的液化制备燃料 | B. | 分馏石油制汽油 | ||
| C. | 可以用热的纯碱溶液除去油污 | D. | 医用酒精用于皮肤的消毒 |
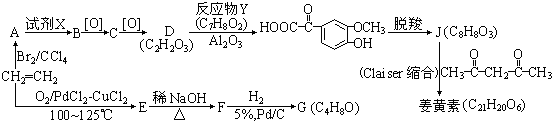
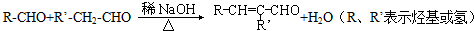
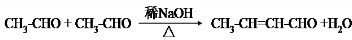 .
.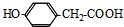 .
.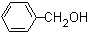 和乙醛为起始原料(其他无机试剂可任选),制备
和乙醛为起始原料(其他无机试剂可任选),制备 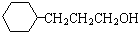 的合成路线,合成路线流程图示例如下:
的合成路线,合成路线流程图示例如下: .
.