题目内容
下列有关反应热的说法正确的是( )
| A、在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量 |
| B、甲烷的燃烧热△H=-890kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ?mol-1 |
| C、已知常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1 |
| D、已知:S(s)+O2(g)=SO2(g)△H1=-Q1 kJ?mol-1,S(g)+O2(g)=SO2(g)△H2=-Q2kJ?mol-1,则Q1<Q2 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、反应是不可能自然进行的,无论放热还是吸热反应都要从外界吸收一部分热量达到反应的活化状态,对于放热反应来说是放出的热量大于吸收的热量,对于吸热反应来说是吸收的热量大于放出的热量;
B、甲烷燃烧的热化学方程式中,稳定的氧化物应该是液态水;
C、H2SO4与Ba(OH)2反应生成沉淀,也释放出热量,△H小于-114.6 kJ?mol-1;
D、S(g)变化为S(s)还要释放出热量,所以Q1>Q2.
B、甲烷燃烧的热化学方程式中,稳定的氧化物应该是液态水;
C、H2SO4与Ba(OH)2反应生成沉淀,也释放出热量,△H小于-114.6 kJ?mol-1;
D、S(g)变化为S(s)还要释放出热量,所以Q1>Q2.
解答:
解:A、反应是不可能自然进行的,无论放热还是吸热反应都要从外界吸收一部分热量达到反应的活化状态,对于放热反应来说是放出的热量大于吸收的热量,对于吸热反应来说是吸收的热量大于放出的热量,故A错误;
B、甲烷燃烧的热化学方程式中,稳定的氧化物应该是液态水,故B错误;
C、H2SO4与Ba(OH)2反应生成沉淀,也释放出热量,△H小于-114.6 kJ?mol-1,故C错误;
D、S(g)变化为S(s)还要释放出热量,所以Q2>Q1,故D正确;
故选D.
B、甲烷燃烧的热化学方程式中,稳定的氧化物应该是液态水,故B错误;
C、H2SO4与Ba(OH)2反应生成沉淀,也释放出热量,△H小于-114.6 kJ?mol-1,故C错误;
D、S(g)变化为S(s)还要释放出热量,所以Q2>Q1,故D正确;
故选D.
点评:本题考查了焓变、燃烧热、中和热等基本概念,理解其内涵是基础,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 如图是两组物质之间在一定的条件下相互转化的过程.下列绿色植物通过光合作用说法不正确的是( )
如图是两组物质之间在一定的条件下相互转化的过程.下列绿色植物通过光合作用说法不正确的是( )| A、物质X是O2 |
| B、绿色植物通过光合作用,将太阳能转化成化学能 |
| C、C6H12O6是碳氢氧三种元素组成的化合物 |
| D、C6H12O6与X反应生成CO2和H2O属于置换反应 |
 已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )
已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )| A、前10min内,用v(A)为0.02mol/(L?min) |
| B、反应进行前10min时,体系吸收热量9.76kJ |
| C、b、c、d三点中反应速率d>b=c |
| D、25min时,导致平衡移动的原因是升温 |
每年5月31日为世界无烟日.吸烟有害健康,下列属于烟气中的一种有毒气体是( )
| A、O2 |
| B、N2 |
| C、CO |
| D、CO2 |
Na2O2、CaC2都是离子化合物,都能与水反应放出气体.它们 ( )
| A、阴阳离子个数比均为1:1 |
| B、都含有非极性的共价键 |
| C、与水都发生氧化还原反应 |
| D、放出的都是可燃性气体 |
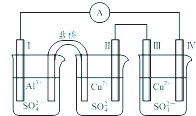 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )| A、电子流动方向:电极Ⅳ→A→电极Ⅰ |
| B、电极Ⅰ发生氧化反应 |
| C、电极Ⅱ质量不变 |
| D、电极Ⅲ的电极反应:Cu2++2e-=Cu |
下列有关化学用语书写正确的是( )
A、用两根铜棒电解盐酸:2H++2Cl-
| ||||
| B、14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3O2(g)═2H2O(g)+2CO2(g)△H=-2b kJ?mol-1 | ||||
| C、向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++HCO3-+OH-=CaCO3↓+2H2O | ||||
| D、在酸性碘化亚铁溶液中通入少量氧气:4I-+O2+4H+=2I2+2H2O |
在2A+B=3C+4D的反应中,下列表示该反应速率最大的是( )
| A、VA=0.5mol/(L.min) |
| B、VB=0.3mol/(L.min) |
| C、Vc=2.4mol/(L.min) |
| D、VD=1mol/(L.min) |
