题目内容
20.表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.试用元素符号、离子符号或化学式回答下列问题.| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 4 | ② | ④ |
(2)元素⑦的氢化物常温下和元素②的单质反应的化学方程式2K+2H2O=2KOH+H2↑;
(3)①和⑦两元素形成四核化合物的电子式
 ,该物质中含有的化学键类型为离子键与共价键(或非极性键);
,该物质中含有的化学键类型为离子键与共价键(或非极性键);(4)①的最高价氧化物对应水化物和⑤的最高价氧化物相互反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是Na、K、Mg、Ca、Al、C、O、P、Cl、Ar元素,
(1)同一周期元素中,元素的金属性随着原子序数的增大而减弱,元素的金属性越强,其最高价氧化物的水化物的碱性越强;
(2)⑦是O元素,其氢化物是水,②是K元素,水和钾反应生成氢氧化钾和氢气;
(3)①和⑦两元素形成四核化合物为Na2O2;过氧化钠为离子化合物,由离子构成;
(4)①的最高价氧化物对应水化物(NaOH)和⑤的最高价氧化物(Al2O3)反应生成偏铝酸钠和水.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是Na、K、Mg、Ca、Al、C、O、P、Cl、Ar元素,
(1)同一周期元素中,元素的金属性随着原子序数的增大而减弱,元素的金属性越强,其最高价氧化物的水化物的碱性越强,所以这几种元素中金属性最强的是Na元素,其最高价氧化物的水化物是NaOH,故答案为:NaOH;
(2)⑦是O元素,其氢化物是水,②是K元素,水和钾反应生成氢氧化钾和氢气,化学反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:H2O;2K+2H2O=2KOH+H2↑;
(3)①和⑦两元素形成四核化合物为Na2O2,其电子式为 .
.
过氧化钠是离子化合物,由钠离子与过氧根离子构成,钠过氧根离子电子式为 ,所以过氧化钠的电子式为
,所以过氧化钠的电子式为 ,含离子键和O-O非极性共价键,
,含离子键和O-O非极性共价键,
故答案为: ;离子键与共价键(或非极性键);
;离子键与共价键(或非极性键);
(4)①的最高价氧化物对应水化物NaOH和⑤的最高价氧化物Al2O3反应生成偏铝酸钠和水,反应离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查位置结构性质的关系及应用,题目难度中等,注意根据元素所在周期表中的位置结合元素周期律知识解答.

| A. | 电子层数:P<S<Cl | B. | 最高正化合价:N<O<F | ||
| C. | 原子半径:C<N<O | D. | 金属性:Na>Mg>Al |
| A. | NO3-向阴极移动,K+向阳极移动,分别在对应的极上析出 | |
| B. | 随电解的进行,溶液的pH减小 | |
| C. | OH-向阳极移动,阳极附近溶液显碱性 | |
| D. | 阴极上H+得电子被还原成H2,促进水的电离平衡正向移动,富集下来的OH-使得阴极附近溶液呈碱性 |
| A. | 苯酚能与NaOH溶液反应,而己醇不能 | |
| B. | 乙烯可发生加成反应,而乙烷不能 | |
| C. | 苯酚能与浓溴水反应,而苯不可以 | |
| D. | 丙酮(CH3COCH3)分子中的氢原子比乙烷分子中的氢原子更易被卤原子取代 |
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 与 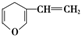 互为同分异构体的芳香族化合物有5种 互为同分异构体的芳香族化合物有5种 | |
| C. | 结构简式为 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| D. | 菲的结构简式为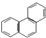 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |

下列说法正确的是( )
| A. | 1mol中间体X最多能与2molH2发生加成反应 | |
| B. | β-紫罗兰酮不能使酸性KMnO4溶液褪色 | |
| C. | 维生素A1难溶于NaOH溶液 | |
| D. | β-紫罗兰酮与中间体X互为同分异构体 |
| 序号 | 物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | KMnO4溶液 | 洗气 |
| B | 溴苯(苯) | 液溴 | 分液 |
| C | 硝基苯(硝酸) | NaOH溶液 | 分液 |
| D | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |