题目内容
10.下列各组元素性质的比较中,正确的是( )| A. | 电子层数:P<S<Cl | B. | 最高正化合价:N<O<F | ||
| C. | 原子半径:C<N<O | D. | 金属性:Na>Mg>Al |
分析 A、P、S、Cl都三个电子层;
B、F、O无正价;
C、同周期从左到右半径逐小;
D、同周期从左到右金属性减弱.
解答 解:A、P、S、Cl都三个电子层,所以电子层数相同,故A错误;
B、F、O无正价,故B错误;
C、同周期从左到右半径逐小,所以原子半径:C>N>O,故C错误;
D、同周期从左到右金属性减弱,所以金属性:Na>Mg>Al,故D正确;
故选D.
点评 本题考查元素周期律知识,涉及原子半径、金属性、化合价等知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握周期律的递变规律,学习中注意积累.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
20.五种短周期主族元素X、Y、Z、W、R的原子序数依次增大,X是周期表中非金属性最强的元素;Y是短周期中原子半径最大的元素;Z是地壳中含量最多的金属元素;W最外层电子数是K层电子数的3倍.下列说法正确的是( )
| A. | 离子半径:Y>Z>W>R>X | |
| B. | 氢化物稳定性:X>W>R | |
| C. | Y、Z、W的最高价氧化物对应的水化物两两均可互相反应 | |
| D. | Y与Z不能存在于同一离子化合物中 |
1.已知A、B、C、D为短周期元素,A、D同主族,B、C、D同周期,A的气态氢化物的稳定性大于D的气态化物的稳定性,B、C为金属元素,B的阳离子的氧化性小于C的阳离子的氧化性.下列说法正确的是( )
| A. | A与B形成的化合物中只含离子键 | |
| B. | A的气态氢化物的沸点一定高于D的气态氢化物的沸点 | |
| C. | 若A与C的原子序数相差5,则二者形成化合物的化学式一定为C2A3 | |
| D. | 相同条件下,B的最高价氧化物的水化物的碱性比C的最高价氧化物的水化物的碱性强 |
2.W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示.W、X、Y、Z原子的最外层电子数之和为21.下列说法中错误的是( )
| W | ||||
| X | Y | Z |
| A. | 元素X的单质能与强酸、强碱反应 | |
| B. | 简单阴离子的还原性:W>Z | |
| C. | 气态氢化物的稳定性:W>Y | |
| D. | 元素W、X与钠元素可形成化合物Na3XW6 |
19.下列关于氦原子电子云图的说法正确的是( )
| A. | 通常用小黑点来表示电子的多少,黑点密度大,电子数目大 | |
| B. | 黑点密度大小,表示单位体积内电子出现的机会多少 | |
| C. | 通常用小黑点来表示电子绕核作高速圆周运动 | |
| D. | 电子云图是对运动无规律性的描述 |
20.表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.试用元素符号、离子符号或化学式回答下列问题.
(1)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是NaOH;(填化学式)
(2)元素⑦的氢化物常温下和元素②的单质反应的化学方程式2K+2H2O=2KOH+H2↑;
(3)①和⑦两元素形成四核化合物的电子式 ,该物质中含有的化学键类型为离子键与共价键(或非极性键);
,该物质中含有的化学键类型为离子键与共价键(或非极性键);
(4)①的最高价氧化物对应水化物和⑤的最高价氧化物相互反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 4 | ② | ④ |
(2)元素⑦的氢化物常温下和元素②的单质反应的化学方程式2K+2H2O=2KOH+H2↑;
(3)①和⑦两元素形成四核化合物的电子式
 ,该物质中含有的化学键类型为离子键与共价键(或非极性键);
,该物质中含有的化学键类型为离子键与共价键(或非极性键);(4)①的最高价氧化物对应水化物和⑤的最高价氧化物相互反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
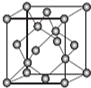 AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.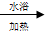 CH3CH2COONH4+3NH3+2Ag+H2O.在此过程中丙醛发生氧化(氧化、还原)反应,此反应可以检验醛基的存在.
CH3CH2COONH4+3NH3+2Ag+H2O.在此过程中丙醛发生氧化(氧化、还原)反应,此反应可以检验醛基的存在.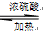 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.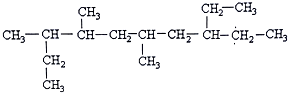
 的分子式为:C4H8O.
的分子式为:C4H8O.