题目内容
17.标准状况下容积为V mL的烧瓶收集满HCl气体.(1)烧瓶内盛装的气体的物质的量为$\frac{V}{22400}$mol;
(2)烧瓶中气体的原子总数是$\frac{V{N}_{A}}{11200}$个;
(3)若集满空气该烧瓶为a g,集满HCl时的质量为(a+$\frac{15V}{44800}$)g;
(4)将烧瓶中HCl做喷泉实验,水充满烧瓶,假设HCl没有损失,该溶液质量分数为0.16%,物质的量浓度为0.045mol•L-1.(溶液密度近似为1g/mol)
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算HCl物质的量;
(2)根据N=nNA计算HCl分子数目,原子数目为HCl分子的2倍;
(3)HCl与空气体积相等,相同条件下二者物质的量相等,结合m=nM计算二者质量之差,进而计算集满HCl时的总质量;
(4)溶液体积等于HCl的体积均为V mL,根据m=ρV计算溶液的质量,根据m=nM计算HCl质量,进而计算HCl的质量分数,根据n=$\frac{n}{V}$计算溶液体积.
解答 解:(1)HCl的体积为VmL,标况下HCl物质的量为$\frac{V×1{0}^{-3}L}{22.4L/mol}$=$\frac{V}{22400}$mol,故答案为:$\frac{V}{22400}$mol;
(2)原子数目为HCl分子的2倍,则含有原子数目为$\frac{V}{22400}$mol×NAmol-1×2=$\frac{V{N}_{A}}{11200}$,故答案为:$\frac{V{N}_{A}}{11200}$;
(3)HCl与空气体积相等,相同条件下二者物质的量相等,集满HCl时由集满空气的质量之差为$\frac{V}{22400}$mol×(36.5g/mol-29g/mol)=$\frac{15V}{44800}$g,则集满HCl时的质量为(a+$\frac{15V}{44800}$)g,故答案为:(a+$\frac{15V}{44800}$);
(4)溶液体积等于HCl的体积均为V mL,溶液的质量=V mL×1g/mL=V g,HCl质量为$\frac{V}{22400}$mol×36.5g/mol,则溶液中HCl的质量分数为$\frac{\frac{36.5V}{22400}g}{Vg}$×100%=0.16%,溶液物质的量浓度=$\frac{\frac{V}{22400}mol}{V×1{0}^{-3}L}$=0.045mol/L,故答案为:0.16%;0.045.
点评 本题考查物质的量计算、质量分数计算等,是字母型计算,属于易错题目,难度不大.

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | N2O4的体积分数减小 | B. | NO2的转化率提高 | ||
| C. | 平均相对分子质量增大 | D. | 颜色变深 |
| A. | 对该反应体系加热 | B. | 不用铁片,改用铁粉 | ||
| C. | 不用稀硫酸,改用98%的浓硫酸 | D. | 滴加少量的CuSO4溶液 |
| A. | F2、Cl2、Br2、I2的氧化性逐渐减弱,密度逐渐增大,熔沸点逐渐升高 | |
| B. | HF、HCl、HBr、HI的热稳定性逐渐减弱 | |
| C. | F-、Cl-、Br-、I-的还原性逐渐增强,颜色逐渐变深 | |
| D. | 与水反应由难到易:F2>Cl2>Br2>I2 |
| A. | 若升高温度,气体颜色将变深 | |
| B. | 平衡时NO2和N2O4的物质的量之比为1:2 | |
| C. | 平衡时混合气体的平均相对分子质量约为76.7 | |
| D. | 若相同温度下的另一容器中N2O4浓度为0.03mol/L,NO2浓度为0.01mol/L时,反应速率的关系为v正<v逆 |

| A. | Cu是原电池的负极 | |
| B. | Al是原电池的负极 | |
| C. | 电子由Al沿导线流向铜 | |
| D. | 铝片上的电极反应式为:Al-3e-═AL3+ |

| A. | 化合物2在一定条件下可发生加聚反应 | |
| B. | 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液 | |
| C. | 理论上反应1→2中原子利用率100% | |
| D. | 化合物2→3的反应为消去反应 |


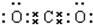


 .
.