题目内容
14.金属钛(Ti)性能优越,被称为“亲生物金属”.工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下: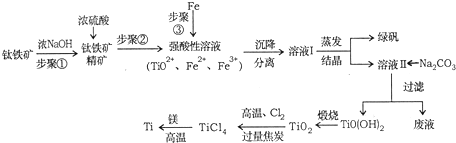
已知:①2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4 +2H2O
②TiO2+易水解,只能存在于强酸性溶液中.
(1)步骤①中发生反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,SiO2+2OH-=SiO32-+H2O.
(2)25℃时,难溶电解质形成沉淀与pH关系如下表
| PH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | TiO(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
a.步骤①加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
b.向溶液Ⅱ中加入Na2CO3粉末的作用是调节PH,生成TiO(OH)2溶液.溶液Ⅱ中大量含有的阳离子有TiO2+、Fe2+、H+.
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti.
①写出由TiO2制取TiCl4的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
②依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/ | 136.4 | 1090 | 1412 | 3287 |
分析 钛铁矿先用浓氢氧化钠溶液溶解,Al2O3、SiO2发生反应,过滤分离,钛铁矿精矿用浓硫酸溶解得到强酸溶液中主要含有TiO2+、Fe2+、Fe3+等,加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩、冷却结晶得到绿矾,过滤得到溶液中主要含有TiO2+、Fe2+、H+等离子,再加入碳酸钠析出TiO(OH)2,加热煅烧得到TiO2,加入氯气、过量碳高温反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属.
(1)步骤I中氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水;
(2)a.由溶度积可知,步骤II加入铁屑,将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
b.溶液Ⅱ中大量含有的阳离子有 TiO2+、Fe2+、H+;
(3)①TiO2与氯气、过量碳高温加热反应生成TiCl4和一氧化碳;
②TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,采用真空蒸馏的方法分离得到Ti,由物质的熔沸点,可知应加热使Mg、MgCl2转化为蒸汽,而Ti不能转化为蒸汽;
(4)根据离子方程式计算25mL溶液中FeSO4的物质的量,再计算2.850g样品中FeSO4•7H2O的质量,进而计算样品中FeSO4•7H2O的质量分数.
解答 解:钛铁矿先用浓氢氧化钠溶液溶解,Al2O3、SiO2发生反应,过滤分离,钛铁矿精矿用浓硫酸溶解得到强酸溶液中主要含有TiO2+、Fe2+、Fe3+等,加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩、冷却结晶得到绿矾,过滤得到溶液中主要含有TiO2+、Fe2+、H+等离子,再加入碳酸钠析出TiO(OH)2,加热煅烧得到TiO2,加入氯气、过量碳高温反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属.
(1)步骤I中氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;
(2)a.由溶度积可知,步骤II加入铁屑原因是:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,
故答案为:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
b.溶液Ⅱ中大量含有的阳离子有 TiO2+、Fe2+、H+,
故答案为:TiO2+、Fe2+、H+;
(3)①TiO2与氯气、过量碳高温加热反应生成TiCl4和一氧化碳,反应方程式为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
②TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,采用真空蒸馏的方法分离得到Ti,由物质的熔沸点,可知应加热使Mg、MgCl2转化为蒸汽,而Ti不能转化为蒸汽,需加热的温度略高于1412℃即可,
故答案为:1412;
(4)由5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,可知25mL溶液中FeSO4的物质的量为5×0.02L×0.01mol/L=0.001mol,则2.850g样品中FeSO4•7H2O的质量为0.001mol×$\frac{250mL}{25mL}$×278g/mol=2.78g,故样品中FeSO4•7H2O的质量分数为$\frac{2.78g}{2.850g}$×100%=97.5%.
故答案为:97.5%.
点评 本题考查物质准备工艺流程,涉及对操作与原理的分析评价、物质的分离提纯、陌生方程式的书写、物质含量测定、对数据的运用用等,侧重考查学生的阅读获取信息、分析解决问题的能力,是对学生综合能力的考查.

| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 | |
| C. | 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 | |
| D. | 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁 |
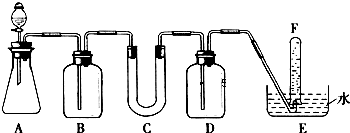
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
在此反应中,过氧化钠的作用是③(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂.
(4)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗的活塞,用拇指堵住试管口,取出试管,立即用带火星的木条伸到试管F的管口,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂.
| A. | Na2C2O4溶液中,2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等体积等物质的量浓度的NaCl和NaClO溶液,两份溶液中离子总数相比前者大 | |
| D. | 0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |

 ;
; ;
;
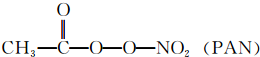 等二次污染物.
等二次污染物.