题目内容
6.下列各组物质都属于强电解质的是( )| A. | 乙醇、氯化钠、氨气、干冰 | B. | 碳酸、氯化钠、乙酸、冰 | ||
| C. | 草酸、碳酸氢钠、氯化钠、碳酸钙 | D. | 硫酸、硫酸钡、醋酸铵、胆矾 |
分析 电解质是指:在水溶液或熔融状态下都能导电的化合物.能导电是电解质自身能电离出自由移动的离子;单质、混合物既不是电解质也不是非电解质.强电解质是指在水溶液中,或熔融状态下能完全电离的化合物,据此即可解答.
解答 解:A.乙醇是非电解质、氯化钠是电解质、氨气属于非电解质、干冰属于非电解质,故A错误;
B.碳酸是弱电解质、氯化钠是电解质、乙酸是弱电解质、冰属于水是弱电解质,故B错误;
C.草酸属于弱电解质、碳酸氢钠、氯化钠、碳酸钙都是强电解质,故C错误;
D.硫酸是强酸、硫酸钡、醋酸铵、胆矾都是盐,物质都属于强电解质,故D正确;
故选D.
点评 本题考查了强电解质的判断,抓住强电解质是在水溶液中或熔融状态下,能完全电离是解答本题的关键,题目难度不大,平时学习注意概念的辨析、基础知识的积累,题目难度中等.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
2.下列两种物质发生反应:①Na和O2②A1Cl3与氨水 ③水玻璃与CO2 ④Fe与Cl2⑤Fe和稀HNO3,因反应物用量或反应条件的不同而生成不同产物的是( )
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②⑤ |
14.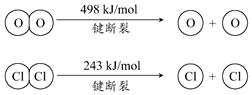 用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:
用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:
4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=-115.6 kJ•mol-1
下列说法正确的是( )
 用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:
用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=-115.6 kJ•mol-1
下列说法正确的是( )
| A. | 升高温度能提高HCl的转化率 | |
| B. | 加入催化剂,能使该反运的焓变减小 | |
| C. | 1molCl2转化为2molCl原子放出243kJ热量 | |
| D. | 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高 |
1.下列溶液可以盛放在玻璃试剂瓶中但不能用磨口玻璃塞的是( )
| A. | 稀盐酸溶液 | B. | 氢氟酸 | C. | 氢氧化钠溶液 | D. | 氯化钠溶液 |
11.根据表(部分短周期元家的原子半径及主要化合价)信息,完成有关问题:
(1)A、B、D、E的简单离子半径由大到小的顺序是S2->O2->Na+>Al3+(用具体离子符号表示);
(2)B单质和C单质的化学性质相似,试写出C单质与强碱溶液反应的离子方程式Be+2OH-=BeO22-+H2↑;
(3)D和E组成的两种化合物中具有漂白性的是SO2,该化合物转化为另一种化合物的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3 ;
(4)已知A的氢化物能与水反应生成一种可燃性气体和一种强碱,试写出该反应的化学方程式NaH+H2O=NaOH+H2↑.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
(2)B单质和C单质的化学性质相似,试写出C单质与强碱溶液反应的离子方程式Be+2OH-=BeO22-+H2↑;
(3)D和E组成的两种化合物中具有漂白性的是SO2,该化合物转化为另一种化合物的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3 ;
(4)已知A的氢化物能与水反应生成一种可燃性气体和一种强碱,试写出该反应的化学方程式NaH+H2O=NaOH+H2↑.
18.下列物质属于纯净物的是( )
| A. | 普通玻璃 | B. | 空气 | C. | 漂白粉 | D. | 干冰 |
15.常温下,某溶液中H+的物质的量浓度是OH-的10000倍,该溶液的PH值是( )
| A. | 5 | B. | 8 | C. | 9 | D. | 6 |
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义. B.
B. C.
C. D.
D.