题目内容
15.下列各组离子中,加入盐酸或NaOH溶液都能大量共存的是( )| A. | Na+、Cl-、Br-、I- | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | Al3+、K+、HCO3-、Cl- | D. | Na+、K+、Ag+、NO3- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、不能发生相互促进水解反应等,则离子大量共存,以此来解答.
解答 解:A.该组离子与盐酸或NaOH均不反应,可大量共存,故A选;
B.Ba2+、SO42-结合生成沉淀,不能共存,故B不选;
C.Al3+、HCO3-相互促进水解,Al3+、HCO3-均与NaOH反应,HCO3-与HCl反应,不能共存,故C不选;
D.加盐酸或NaOH时Ag+、Cl-(或OH-)结合生成沉淀,不能共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
3.不能与溴水发生反应的是( )
①甲苯 ②邻甲基苯酚 ③亚硫酸 ④2-丁炔 ⑤AgNO3溶液 ⑥裂化汽油 ⑦1,3-丁二烯 ⑧环己烷 ⑨葡萄糖 ⑩乙醛.
①甲苯 ②邻甲基苯酚 ③亚硫酸 ④2-丁炔 ⑤AgNO3溶液 ⑥裂化汽油 ⑦1,3-丁二烯 ⑧环己烷 ⑨葡萄糖 ⑩乙醛.
| A. | ①⑤ | B. | ①⑥⑨ | C. | ①⑧ | D. | ①②⑤⑦ |
20.下列配合物的配位数不是6的是( )
| A. | K3[Fe(SCN)6] | B. | [Cu(NH3)4]Cl2 | C. | Na3[AlF6] | D. | Na2[SiF6] |
7.下列事实能说明金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应生成的阳离子,甲离子的化合价比乙高.
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应生成的阳离子,甲离子的化合价比乙高.
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②⑤可以 | D. | ①③④可以 |
4.下列说法正确的是( )
| A. | 0.1mol/L NH4Al(SO4)2溶液中离子浓度大小关系为c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1 HA(一元酸)溶液与0.1 mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)═c(OH-)+c(A-) | |
| C. | 将0.1 mol/L的醋酸溶液加水稀释的过程中,溶液里所有离子浓度都减小 | |
| D. | 向CaSO4和BaSO4沉淀共存的体系中加入少量BaCl2,溶液中c(Ca2+)减小 |
 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{充电}^{放电}$2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{充电}^{放电}$2K2CO3+6H2O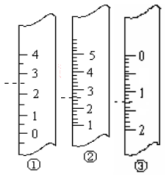 (1)如图分别是温度计、量筒、滴定管的一部分,则:温度计应该是①,读数是2.5℃,量筒应该是②,读数为2.5 mL,滴定管应该是③,读数为1.30 mL
(1)如图分别是温度计、量筒、滴定管的一部分,则:温度计应该是①,读数是2.5℃,量筒应该是②,读数为2.5 mL,滴定管应该是③,读数为1.30 mL