题目内容
14.在常温下15mLpH=11的KOH溶液中,加入pH=3的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是( )| A. | [A-]=[K+] | B. | [H+]=[OH-]<[K+]<[A-] | C. | V总≥30mL | D. | V总≤30mL |
分析 pH=11的KOH溶液,c(OH-)=0.001mol/L,pH=3的一元酸HA溶液若强酸,c(H+)=c(HA)=0.001mol/L,混合后pH=7,则等体积混合;
若酸为弱酸,c(HA)>0.001mol/L,混合后pH=7时,应为醋酸和醋酸钾的混合溶液,其体积应小于15mL,以此来解答.
解答 解:pH=11的KOH溶液,c(OH-)=0.001mol/L,pH=3的一元酸HA溶液若强酸,c(H+)=c(HA)=0.001mol/L,混合后pH=7,则等体积混合;
若酸为弱酸,c(HA)>0.001mol/L,混合后pH=7时,应为醋酸和醋酸钾的混合溶液,其体积应小于15mL,即V总≤30mL,
又pH=7,则c(OH-)=c(H+),由电荷守恒可知,c(H+)+c(K+)=c(OH-)+c(A-),则c(A-)=c(K+),
溶液中显性离子浓度大于隐性离子浓度,所以c(A-)=c(K+)>c(OH-)=c(H+),
故选AD.
点评 本题考查酸碱混合溶液的计算,明确酸的强弱及电荷守恒是解答本题的关键,注意酸为弱酸时浓度大,其体积应小于碱的体积才能满足混合溶液的pH=7,题目难度中等.

练习册系列答案
 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
4.在水溶液中能大量共存的一组离子是( )
| A. | CO32-、H+、NO3-、Na+ | B. | OH-、K+、NO3-、Cl- | ||
| C. | Mg2+、H+、OH-、SO42- | D. | Na+、Cu2+、OH-、SO42- |
5.下表列出了①~⑨九种元素在周期表中的位置.
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)K;元素⑤的原子结构示意图为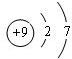 .
.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)CH4.
(3)写出元素⑧的单质与水反应的化学方程式:2K+2H2O═2KOH+H2↑.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:Cl2+2Br-═Br2+2Cl-.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ||||||
| 4 | ⑧ | ⑨ | ||||||
(1)这九种元素中,原子半径最大的是(填元素符号)K;元素⑤的原子结构示意图为
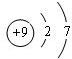 .
.(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)CH4.
(3)写出元素⑧的单质与水反应的化学方程式:2K+2H2O═2KOH+H2↑.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:Cl2+2Br-═Br2+2Cl-.
2.卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义.
(1)下列关于氯水的叙述正确的是AEF(填写序号).
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式NaClO+CO2+H2O═HClO+NaHCO3.若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因ClO-+Cl-+2H+═Cl2↑+H2O.
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)═2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是B(填序号).
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为0.1mol.
③ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.现用ClO2将CN-氧化,有两种气体生成,其离子反应方程式为2ClO2+2CN-=N2↑+2CO2↑+2Cl-.
(1)下列关于氯水的叙述正确的是AEF(填写序号).
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)═2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是B(填序号).
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为0.1mol.
③ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.现用ClO2将CN-氧化,有两种气体生成,其离子反应方程式为2ClO2+2CN-=N2↑+2CO2↑+2Cl-.
9.下列气体属于无色、无味、有毒的气体是( )
| A. | CO | B. | SO2 | C. | CO2 | D. | H2S |
19.洗涤下列试管时,选用的试剂(括号中物质)不妥当的是( )
| A. | 做过KMn04分解反应实验的试管(浓盐酸) | |
| B. | 做过木炭还原氧化铜实验的试管(硝酸) | |
| C. | 做过银镜反应实验的试管(氨水) | |
| D. | 做过Na2S2O3与稀硫酸反应的试管(二硫化碳) |
2. 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )| A. | ab段表示电解过程中H+被还原,pH上升 | |
| B. | 电解开始时阳极先发生电极反应2Cl--2e-═Cl2↑ | |
| C. | 电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 | |
| D. | 原混合溶液中KCl和CuSO4的浓度之比恰好为2:1 |
19.下列有关说法正确的是( )
| A. | 在任何条件下,纯水都呈中性 | |
| B. | 电离平衡常数Ka越小,表示弱电解质电离能力越强 | |
| C. | 为保存FeCl3溶液,要在溶液中加少量硫酸 | |
| D. | 明矾溶液蒸干得到的固体为Al(OH)3 |
20.下列叙述中,正确的是( )
| A. | 在标准状况下,1mol任何物质的体积为22.4L | |
| B. | 等物质的量的HCl和 H 2 SO4中,H+的物质的量也相等 | |
| C. | 1molH 2和1molHe中,所含的分子数相同、原子数相同、质量也相同 | |
| D. | 体积为6L的 O 2,其质量可能为8g |