题目内容
12.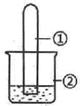 用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | HCHO | 新制Cu(OH)2悬浊液 | 产生白色沉淀 |
| D | CH3Cl | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化氮与水反应生成硝酸和NO,NO不溶于水;
B.二氧化硫与水反应生成亚硫酸,溶液显酸性;
C.HCHO与新制Cu(OH)2悬浊液加热反应生成砖红色沉淀;
D.CH3Cl不能电离出氯离子.
解答 解:A.二氧化氮与水反应生成硝酸和NO,NO不溶于水,则试管中不能充满无色溶液,故A错误;
B.二氧化硫与水反应生成亚硫酸,溶液显酸性,则紫色石蕊溶液变为红色,故B正确;
C.HCHO与新制Cu(OH)2悬浊液加热反应生成砖红色沉淀,不是白色沉淀,故C错误;
D.CH3Cl不能电离出氯离子,与硝酸银溶液不能发生反应,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象为解答该题的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
3.某温度下,向2L的密闭容器中加入1molX和2molY:X(g)+mY(g)?3Z(g),平衡时X、Y、Z的体积分数分别为30%、60%、10%.向平衡体系中再加入1molZ,重新建立平衡时X、Y、Z的体积分数不变.下列叙述不正确的是( )
| A. | m=2 | |
| B. | X与Y的转化率相等 | |
| C. | 该温度下的平衡常数约为9.3×10-3 | |
| D. | 重新建立平衡时Z的浓度为0.4mol•L-1 |
7.实验室从含溴化钠的废液中提取溴单质,下列说法中能达到实验目的是( )
| A. |  用装置甲氧化废液中的溴化钠 | B. |  用装置乙分离CCl4层和水层 | ||
| C. |  用装置丙分离CCl4和液溴 | D. |  用仪器丁长期贮存液溴 |
17.海洋资源有巨大的开发潜力,人类正着力进行海水的综合利用.
(1)以海水为原料生产海盐过程中产生苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子).从苦卤中可提取溴,其生产流程如下:
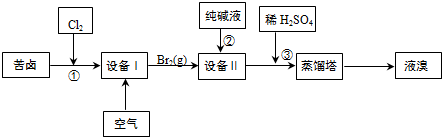
①在设备Ⅰ中用空气吹出Br2,并在设备Ⅱ中用纯碱溶液吸收,发生反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,若吸收1mol Br2,转移的电子数为$\frac{5}{3}$mol.
②所用的设备名称为(填序号):设备ⅠB设备ⅡA
A.吸收塔 B.吹出塔 C.分馏塔 D.压滤机
③步骤③中发生反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O.
④蒸馏塔中蒸馏温度控制在90℃左右的原因是顺利将溴蒸出,同时防止水馏出.
(2)从海水中提取镁的工艺流程如下:
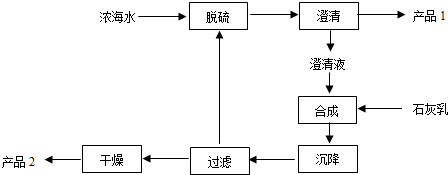
浓海水中的离子浓度如下:
产品1是脱硫阶段产生的沉淀,其主要成分的化学式为CaSO4,1L浓海水最多可得到产品2的质量为69.6g.
(3)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号)
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺.
(1)以海水为原料生产海盐过程中产生苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子).从苦卤中可提取溴,其生产流程如下:

①在设备Ⅰ中用空气吹出Br2,并在设备Ⅱ中用纯碱溶液吸收,发生反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,若吸收1mol Br2,转移的电子数为$\frac{5}{3}$mol.
②所用的设备名称为(填序号):设备ⅠB设备ⅡA
A.吸收塔 B.吹出塔 C.分馏塔 D.压滤机
③步骤③中发生反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O.
④蒸馏塔中蒸馏温度控制在90℃左右的原因是顺利将溴蒸出,同时防止水馏出.
(2)从海水中提取镁的工艺流程如下:

浓海水中的离子浓度如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(3)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号)
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺.
4.下列关于乙醇和乙酸的说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 医用酒精属于混合物,醋酸是一元弱酸 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
1.下列说法不正确的是( )
| A. | 食盐、糖和醋都可做食品防腐剂 | |
| B. | 青蒿素可以用于治疗疟疾 | |
| C. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
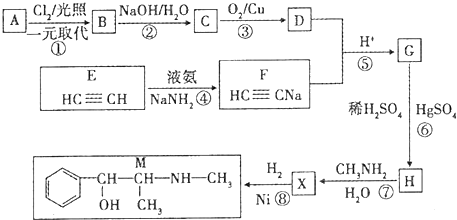
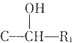
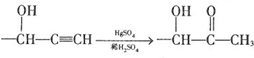
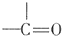 $→_{H_{2}O}^{RNH_{2}}$
$→_{H_{2}O}^{RNH_{2}}$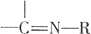
 .
.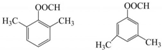 .
.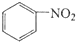 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$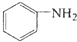 参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体
参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体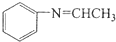 的路线
的路线 .
.