题目内容
4.某化学反应的△H=-122kJ/mol,△S=+231J/(mol•K),下列说法正确的是( )| A. | 此反应在任何温度下都能自发进行 | |
| B. | 此反应仅在低温下自发进行 | |
| C. | 此反应仅在高温下自发进行 | |
| D. | 此反应在任何温度下都不能自发进行 |
分析 依据反应的焓变和熵变结合温度分析计算,△H-T△S<0说明反应自发进行,△H-T△S>0时反应不能自发进行.
解答 解:△H=-122kJ•mol-1,△S=+231J•mol-1•K-1,则:△H-T△S=-122kJ•mol-1-T0.231J•mol-1•K-1<0,所以反应一定是自发进行的反应,所以在任何温度下都能自发进行,
故选:A.
点评 本题考查了反应自发进行的判断依据和计算应用,为高频考点,侧重考查学生的分析、计算能力,注意计算过程中焓变和熵变的正负号应用,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.按要求回答下列有关问题.
(1)据报道,科学家新研发出一种常温下催化合成NH3的方法:N2(g)+6H2O(l)═4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成热可以表示其相对能量.化学上,规定标准状况下稳定单质的生成热为0.几种物质的生成热:NH3(g)为mkJ•mol-1,H2O(l)为nkJ•mol-1.
反应的△H=产物的生成热之和-反应物的生成热之和
②几种化学键的键能数据如下:
上述反应中,△H=4m-6nkJ•mol-1,H-N键的键能为$\frac{2a+12b-3c-4m+6n}{12}$kJ•mol-1.
(2)二氧化硫在一定条件下可以发生如下反应:SO2(g)+NO2(g)?SO3(g)+NO(g),△H=-42kJ•mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)=0.05mol•L-1•min-1;
②实验丙中,达到平衡时,NO2的转化率为$\frac{10a}{3}$×100%;
③由表中数据可推知,Tl<T2(填“>”“<’’或“=”);
(3)对反应N2O4(g)?2NO2(g)△H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图1所示,下列说法正确的是d.

a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A深,C浅
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A=C
(4)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(N为-3价,下同),装置如图2所示,通电过程中,阳极区两种离子的放电产物会进一步发生反应,其方程式为:Cl2+CNO-+OH-→□+Cl-+CO32-+H2O(未配平).最终阴、阳两极均有无色无味气体产生.
①铁电极应连接直流电源的负极(填写电极名称).
②上述反应方程式配平后“□”内应填写N2;
③阳极上发生的电极反应为2Cl--2e-═Cl2↑和CN--2e-+2OH-=CNO-+H2O.
(1)据报道,科学家新研发出一种常温下催化合成NH3的方法:N2(g)+6H2O(l)═4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成热可以表示其相对能量.化学上,规定标准状况下稳定单质的生成热为0.几种物质的生成热:NH3(g)为mkJ•mol-1,H2O(l)为nkJ•mol-1.
反应的△H=产物的生成热之和-反应物的生成热之和
②几种化学键的键能数据如下:
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
(2)二氧化硫在一定条件下可以发生如下反应:SO2(g)+NO2(g)?SO3(g)+NO(g),△H=-42kJ•mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为$\frac{10a}{3}$×100%;
③由表中数据可推知,Tl<T2(填“>”“<’’或“=”);
(3)对反应N2O4(g)?2NO2(g)△H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图1所示,下列说法正确的是d.

a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A深,C浅
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A=C
(4)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(N为-3价,下同),装置如图2所示,通电过程中,阳极区两种离子的放电产物会进一步发生反应,其方程式为:Cl2+CNO-+OH-→□+Cl-+CO32-+H2O(未配平).最终阴、阳两极均有无色无味气体产生.
①铁电极应连接直流电源的负极(填写电极名称).
②上述反应方程式配平后“□”内应填写N2;
③阳极上发生的电极反应为2Cl--2e-═Cl2↑和CN--2e-+2OH-=CNO-+H2O.
16.在强酸性溶液中能大量共存的无色透明离子组是( )
| A. | Mg2+ Na+ Cl- SO42- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ Na+ Cl- Cu2+ | D. | Na+Ba2+OH- SO42- |
13. 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
此合成反应的a>0;△S>0,(填“>”、“<”或“=”).
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
14.Ⅰ、在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
请回答下列问题:
该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“>”、“<”或“=”).
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
(1)容器①中反应达平衡时,CO的转化率为80%.
(2)计算容器②中反应的平衡常数K=1.
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“>”、“<”或“=”).
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)计算容器②中反应的平衡常数K=1.

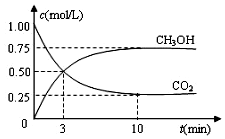 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.