题目内容
16.在强酸性溶液中能大量共存的无色透明离子组是( )| A. | Mg2+ Na+ Cl- SO42- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ Na+ Cl- Cu2+ | D. | Na+Ba2+OH- SO42- |
分析 强酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故A选;
B.酸溶液中不能大量存在CO32-,故B不选;
C.Cu2+为蓝色,与无色不符,故C不选;
D.酸溶液中不能大量存在OH-,且Ba2+、SO42-结合生成沉淀不能共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
7.含有0.20mol Na2CO3的溶液120mL和200mL 盐酸,不管将前者滴加入后者,还是后者滴加前者,都有气体产生,但最终生成的气体积不同,则盐酸的浓度是( )
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
4.某化学反应的△H=-122kJ/mol,△S=+231J/(mol•K),下列说法正确的是( )
| A. | 此反应在任何温度下都能自发进行 | |
| B. | 此反应仅在低温下自发进行 | |
| C. | 此反应仅在高温下自发进行 | |
| D. | 此反应在任何温度下都不能自发进行 |
11.下列表达方式错误的是( )
| A. | CO2的比例模型: | |
| B. | 甲烷的电子式 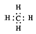 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子构成${\;}_6^{12}$C |
1.下列事实与胶体的性质有关的是( )
①用盐卤点豆腐 ②微波手术能大大减少病人出血量
③用明矾净水 ④江河入海口形成三角洲.
①用盐卤点豆腐 ②微波手术能大大减少病人出血量
③用明矾净水 ④江河入海口形成三角洲.
| A. | 只有①② | B. | 只有①②④有尽有 | C. | 只有①②③ | D. | 全部 |
8.下列离子方程式,书写正确的是( )
| A. | 碳酸钙和盐酸反应 CO32-+2H+=H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液 Ba2++SO42-=BaSO4↓ | |
| C. | 碳酸氢钙溶液与盐酸溶液反应 HCO3-+H+=H2O+CO2↑ | |
| D. | 向稀盐酸溶液中加铁粉 3Fe+6H+=2Fe3++3H2↑ |
6. 水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:
水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:
(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出c(OH-)=0.001mol•L-1.
(2)纯水在100℃时,pH=6,该温度下1mol.L-1的NaOH溶液中,由水电离出的c(OH-)=10-12mol•l-1
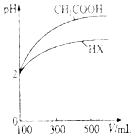
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与体积的关系如图所示,则HX的电离平衡常数小于(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数.
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理置.己知:
①25℃时,有等浓度的NaCN容液、Ma2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
②向NaCN溶液中通入少量的CO2,发生反应化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(5)25℃时,在CH3COOH与CH3COONa的混合洛液中,若测得pH=6,则溶液中CH3COO-)•c(Na+)=9.9×10-7(填精确值)mol•L-1.
 水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:
水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出c(OH-)=0.001mol•L-1.
(2)纯水在100℃时,pH=6,该温度下1mol.L-1的NaOH溶液中,由水电离出的c(OH-)=10-12mol•l-1
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与体积的关系如图所示,则HX的电离平衡常数小于(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数.
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理置.己知:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3x10-7,K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(5)25℃时,在CH3COOH与CH3COONa的混合洛液中,若测得pH=6,则溶液中CH3COO-)•c(Na+)=9.9×10-7(填精确值)mol•L-1.
