题目内容
19.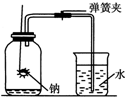 某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.
某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.①上述实验过程中发生反应的化学方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2.
②实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学的广口瓶内水面上升明显大于瓶内空气体积的1/5.下列对这两种现象解释合理的是a、b、c、d.
a.甲同学可能使用钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却时外界空气进入瓶内
c.乙同学可能没夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出.
分析 ①钠在加热条件下与氧气反应生成过氧化钠,据此写出化学反应方程式即可,注意条件;
②a项,若钠的量不足,则氧气消耗不完,造成进水量少于容器容积的$\frac{1}{5}$;
b项,若瓶塞未塞紧,钠熄灭冷却,瓶内气体收缩,外面的空气会进入瓶内,使气体得到补充;
c项,若弹簧夹未夹紧,钠燃烧时,瓶内气体膨胀,使部分气体从导管口逸出;
d项,若插入燃烧匙太慢,钠燃烧时,瓶内气体膨胀,在塞紧瓶塞前,瓶内部分气体从瓶口逸出.
解答 解:①钠在加热条件下与氧气反应生成过氧化钠,化学反应方程式为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
故答案为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;
②a.钠的量不足,瓶内氧气没有消耗完,导致氧气剩余,故瓶内水面上升高度达不到,故a正确;
b.瓶塞未塞紧,钠熄灭冷却时外界空气进入瓶内,导致瓶内压强过大,水面上升高度达不到,故b正确;
c.没夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出,导致瓶内压强减小,水面上升高度超出,故c正确;
d.插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出,导致瓶内压强减小,水面上升高度超出,故d正确,
故选:abcd.
点评 本题主要考查的是钠的性质与空气成分测定实验,掌握实验基础和物质性质是解题关键,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
9.一次性使用的聚苯乙烯材料带来的“白色污染”是一种较为严重的污染现象.最近研制的一种新型材料能代替聚苯乙烯,它是由乳酸聚合而成的,这种材料可以在乳酸菌作用下完全降解生成CO2和H2O.下列关于聚乳酸的说法中,正确的是( )
| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸的聚合方式与聚苯乙烯相似 | |
| C. | 聚乳酸的单体为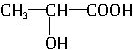 | |
| D. | 聚乳酸的降解过程不需要其他物质参与反应 |
10.关于维生素的下列说法不正确的是( )
| A. | 维生素是生物生长发育和新陈代谢所必需的物质 | |
| B. | 按溶解性的不同,维生素可分为脂溶性维生素和水溶性维生素两类 | |
| C. | 缺乏维生素A易患甲状腺肿大 | |
| D. | 缺乏维生素C易患坏血病 |
14.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,7.5mol CuSO4可氧化磷原子的物质的量为( )
| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |
11.下列各组有机物中,不论两者以何种比例混合,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗的氧气的质量不变的是( )
| A. | C3H8,C4H6 | B. | C3H6,C4H6O2 | C. | C2H2,C6H6 | D. | CH4O,C2H4O2 |
9.下列离子方程式的书写正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| D. | 二氧化碳通入足量澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
 .
.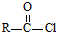
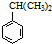 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式

 .
. 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题: