题目内容
2.下列说法正确的是( )| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入足量NH3,产生沉淀 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 盛放氢氧化钠溶液的试剂瓶用橡皮塞,不用玻璃塞 | |
| D. | Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
分析 A.盐酸的酸性大于碳酸,则CO2通入BaCl2溶液不反应,但再通入足量NH3,碳酸铵与氯化钡反应生成碳酸钡沉淀和氯化铵;
B.硝酸盐在酸性条件下具有硝酸的强氧化性;
C.NaOH溶液与玻璃中的二氧化硅反应;
D.红热的Fe与水蒸气反应生成四氧化三铁和氢气.
解答 解:A.盐酸的酸性大于碳酸,则CO2通入BaCl2溶液不反应,但再通入足量NH3,碳酸铵与氯化钡反应生成碳酸钡沉淀和氯化铵,则有沉淀产生,故A正确;
B.硝酸盐在酸性条件下具有硝酸的强氧化性,则在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解,故B错误;
C.NaOH溶液与玻璃中的二氧化硅反应,则盛放氢氧化钠溶液的试剂瓶用橡皮塞,不用玻璃塞,故C正确;
D.红热的Fe与水蒸气反应生成四氧化三铁和氢气,而Na2O2与水反应能生成碱,故D错误;
故选AC.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
12.将铜丝插入浓硫硫加热取出后,在铜丝表面会产生一层黑色固体甲,为研究固体甲的成分,进行下实验.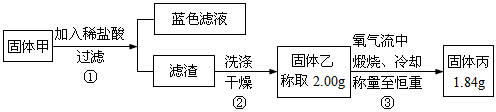
已知,氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,Cu在氧气流中锻烧,可以转化为氧化铜.硫化铜和硫化亚铜常温下都不溶于稀盐,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
下列用关说法正确的是( )

已知,氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,Cu在氧气流中锻烧,可以转化为氧化铜.硫化铜和硫化亚铜常温下都不溶于稀盐,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
下列用关说法正确的是( )
| A. | 加盐酸有蓝色溶液生成,说明固体甲中一定含有氧化铜 | |
| B. | 步骤①所得滤渣中肯定含有单质铜 | |
| C. | 固体甲中若存在Cu2O,也可能有Cu2S | |
| D. | 固体甲中,CuS和Cu2S不能同时存在 |
7.将a g钾钠合金溶于过量100mL b mol/L的稀盐酸中,将溶液加热蒸干后继续灼烧至质量不变时得固体c g.则放出H2的体积在标准状况下是( )
| A. | 2.24b L | B. | $\frac{c-a}{71}$×22.4L | C. | $\frac{c-a}{17}$×22.4L | D. | $\frac{a-c}{35.5}$×22.4L |
14.下列有关海水综合利用的说法正确的是( )
| A. | 从海水中可以得到NaCl,电解熔融NaCl可获得Cl2 | |
| B. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| C. | 海水蒸发制海盐的过程只发生了化学变化 | |
| D. | 利用电解的方法可以从海水中获取淡水 |