题目内容
10.《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…价值数倍也”.其方法与分离下列物质的实验方法原理上相同的是( )| A. | 甲苯和水 | B. | 硝酸钾和氯化钠 | C. | 乙酸乙酯和乙酸 | D. | 食盐水和泥沙 |
分析 题中“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…价值数倍也”,根据物质的沸点不同进行分离,为蒸馏操作,以此解答该题.
解答 解:题中涉及方法为蒸馏.
A.甲苯和水分层,用分液的方法分离,故A错误;
B.硝酸钾和氯化钠的溶解度随温度变化不同,用重结晶的方法分离,故B错误;
C.乙酸乙酯和乙酸沸点不同,可用蒸馏的方法分离,故C正确;
D.泥沙不溶于水,可用过滤的方法分离,故D错误.
故选C.
点评 本题考查物质的分离、提纯,为高频考点,侧重考查学生的分析能力和实验能力,题目难度不大,有利于培养学生良好的科学素养.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.鉴别下列各组有机物,所选用的试剂不正确的是( )
| A. | 鉴别苯与四氯化碳:碘水 | |
| B. | 鉴别甲烷与乙烯:酸性高锰酸钾溶液 | |
| C. | 鉴别 与CH≡CH:溴水 与CH≡CH:溴水 | |
| D. | 鉴别NaCl与CH3CH2Cl:硝酸银溶液 |
1.下列实验操作、现象和对应的实验结论均正确的是( )
| 实验操作和现象 | 实验结论 | |
| A | 检验某溶液中是否含有SO42-时,向溶液中滴加用盐 酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 检验输送氯气的管道是否发生泄漏时,用一根玻璃棒蘸取浓氨水,然后靠近管道 | 有白色烟雾产生时说明管道发生泄漏 |
| C | 检验FeCl3溶液中是否含有Fe2+时,向溶液中滴加 酸性KMnO4溶液,溶液变为无色 | 该溶液中一定含有Fe2+ |
| D | 向2mL0.1mol•L-1 硝酸银溶液中加入几滴0.1mol•L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol•L-1Na2S溶液,有黑色沉淀生成 | 该现象说明相同温度下Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
18.下列反应可用离子方程式“H++OH-→H2O”表示的是( )
| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | NH3•H2O溶液与HCl溶液混合 | ||
| C. | NaHCO3溶液与NaOH溶液混合 | D. | HNO3溶液与KOH溶液混合 |
5.下列叙述中,错误的是( )
| A. | 新制氯水的氧化性强于久置氯水 | |
| B. | 过量铁与Cl2反应时生成FeCl2 | |
| C. | 1molCl2与热NaOH溶液反应生成NaClO3和NaCl时,需NaOH 2mol | |
| D. | 将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有强氧化性 |
15.设NA为阿伏加德罗常数的值,下列物质所含粒子数目为NA的是( )
| A. | 7 g乙烯和丙烯混合气体中的氢原子数目 | |
| B. | 0.5 mol Fe溶于过量HNO3溶液中,转移的电子数目 | |
| C. | 2.5 L 0.4 mol/L 的 Na2CO3 溶液中 CO32-数目 | |
| D. | 标准状况下,5.6 L CCl4含有的共价键数目 |
2.药物阿司匹林可由水杨酸制得,它们的结构如图所示.有关说法正确的是( )

| A. | 1 mol阿司匹林最多可消耗5 molH2 | |
| B. | 水杨酸分子中所有原子可能共面 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 1 mol阿司匹林最多可消耗2 molNaOH |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L0.1mol•L-1的酒精溶液中含氢原子数为0.6NA | |
| B. | 常温常压下,1L1L0.1mol•L-1的醋酸铵溶液中含氮原子数目为0.1NA | |
| C. | 1mol有机物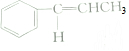 中含有5NA和碳碳双键 中含有5NA和碳碳双键 | |
| D. | 1mol甲基(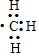 )所含的电子数为7NA )所含的电子数为7NA |
19. 向含NaOH、Ba(OH)2、NaAlO2各1mol的混合溶液中,缓慢通入CO2气体,产生沉淀的量与通入CO2的量图象关系如图所示,下列说法错误的是( )
向含NaOH、Ba(OH)2、NaAlO2各1mol的混合溶液中,缓慢通入CO2气体,产生沉淀的量与通入CO2的量图象关系如图所示,下列说法错误的是( )
 向含NaOH、Ba(OH)2、NaAlO2各1mol的混合溶液中,缓慢通入CO2气体,产生沉淀的量与通入CO2的量图象关系如图所示,下列说法错误的是( )
向含NaOH、Ba(OH)2、NaAlO2各1mol的混合溶液中,缓慢通入CO2气体,产生沉淀的量与通入CO2的量图象关系如图所示,下列说法错误的是( )| A. | a点对应的溶液中,Na+、Fe3+、SO42-、HCO3-能大量共存 | |
| B. | c、d两点对应的溶液中,沉淀的质量相等 | |
| C. | d点对应的溶液中,c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | d点与e点对比,e点溶液的导电性增强 |