题目内容
一定的条件下,合成氨反应为:N2(g)+3H2(g)?2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”).
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 .
③图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)-c(OH-)= (已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3?H2O:Kb=1.8×10-5)

①该反应的平衡常数表达式为
②由图2信息,计算0~10min内该反应的平均速率v(H2)=
③图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈
考点:化学平衡的影响因素,化学平衡的计算
专题:基本概念与基本理论
分析:①由图象1分析,反应是放热反应,依据化学方程式和平衡常数概念分析写出表达式;
②分析图象变化量,计算氮气的反应速率,结合反应速率之比等于系数之比计算得到氢气速率,依据化学反应速率概念计算得到,缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小;
③图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大;
由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,据此解答;
(3)依据溶液中电荷守恒分析.
②分析图象变化量,计算氮气的反应速率,结合反应速率之比等于系数之比计算得到氢气速率,依据化学反应速率概念计算得到,缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小;
③图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大;
由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,据此解答;
(3)依据溶液中电荷守恒分析.
解答:
解:①N2(g)+3H2(g)?2NH3(g),反应的平衡常数K=
,图象1分析可知反应是放热反应,反应物能量高于生成物能量,温度升高平衡逆向进行,平衡常数减小,故答案为:
;减小;
②图象分析2L的密闭容器中,V(N2)=
V(H2)=
=0.015mol/L?min,V(H2)=0.045mol/L?min;
从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线
d符合;
故答案为:0.045mol/L?min;d;
③图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高;
由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,温度越高化学平衡越低,故K1>K2;
故答案为:c;<;
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈酸性,c(OH-)=c(H+),电解质溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-)得到:c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+),故答案为:酸;c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+).
| c 2(NH3) |
| c(N2)c 3(H 2) |
| c 2(NH3) |
| c(N2)c 3(H 2) |
②图象分析2L的密闭容器中,V(N2)=
| 1 |
| 3 |
| ||
| 10min |
从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线
d符合;
故答案为:0.045mol/L?min;d;
③图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高;
由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,温度越高化学平衡越低,故K1>K2;
故答案为:c;<;
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈酸性,c(OH-)=c(H+),电解质溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-)得到:c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+),故答案为:酸;c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+).
点评:本题考查了化学反应和化学平衡影响因素的分析判断,图象分析和平衡常数变化是解题关键,题目难度中等.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
水果削皮后,一接触空气,很快就会被氧化.假如家里要请客,你需要提前把水果削好,但又不能使之变黄,那该怎么办呢?你可以将削好的水果放入一盆水中,然后在水中加入什么调料可以起到这种效果( )
| A、糖 | B、碱 | C、盐 | D、亚硝酸盐 |
煤和石油中的硫燃烧产生的二氧化硫是形成硫酸型酸雨的主要原因,因此要对煤和石油等燃料进行脱硫处理,对应的下列说法正确的是( )
| A、在石油中添加的脱硫剂是石灰石 |
| B、由于硫可溶于CS2,但我们也可以用CS2溶剂溶解煤中的硫,进而实现煤脱硫 |
| C、脱硫后产生的废料中含有的CaCO3,可用于制造建筑材料 |
| D、国际上最新采用“饱和亚硫酸钠溶液吸收法”,其反应为:Na2SO3+SO2+H2O=2NaHSO3 |
进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释正确的是( )
| A、浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成有色产物能溶于浓硝酸 |
| B、在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 |
| C、在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明含SO42- |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
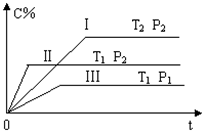 在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:
在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:A(g)+B(g)?xC(g)△H=Q.在不同的温度和压强下,C在反应混合物中的含量随反应时间的变化如图所示.下列判断正确的是( )
| A、T1>T2,Q<0 |
| B、T1<T2,Q>0 |
| C、P1>P2,x=1 |
| D、P1<P2,x≠1 |
小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有( )


| A、复分解反应、1个 |
| B、分解反应、2个 |
| C、化合反应、3个 |
| D、置换反应、2个 |
下列离子方程式书写正确的是( )
| A、氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2C1- |
| B、金属钠投入水中Na+H2O=Na++OH-+H2↑ |
| C、氢氧化亚铁溶于稀硝酸Fe(OH)2+2H+=Fe2++2H2O |
| D、氯化铁溶液中加过量氨水3NH3?H2O+Fe3+=3NH4++Fe(OH)3↓ |
下列微粒中各电子层都达到了2n2个电子的是(n代表电子层数)( )
| A、Ar |
| B、S2- |
| C、Ca2+ |
| D、Na+ |
下列有关溶液中粒子浓度的关系中,正确的是( )
| A、pH相同的①CH3COONa、②NaHCO3、③Na[Al(OH)4]三种溶液中的c(Na+):②>③>① |
| B、10mL0.1mol?L-1CH3COOH溶液与20mL0.1mol?L-1NaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| C、a L0.1mol?L-1CH3COOH溶液与b L 0.1mol?L-1NaOH溶液混合,若a<b,则不一定存在:n(OH-)-n(H+)>0.1(b-a) |
| D、某温度下0.1mol?L-1NaHB溶液中一定存在:c(Na+)≥c(B2-)且pH<7 |