题目内容
11.关于反应CaO+3C→CaC2+CO,下面哪种表述能最好地说明该反应是一个氧化还原反应( )| A. | CaO失氧变为CaC2 | B. | C的状态发生了变化 | ||
| C. | Ca的化合价在反应前后发生了改变 | D. | C失去了电子,同时也得到了电子 |
分析 CaO+3C→CaC2+CO中,C元素的化合价由0降低为-1价,由0升高为+2价,以此来解答.
解答 解:A.CaO失氧没有元素的化合价变化,不能说明为氧化还原反应,故A不选;
B.单质碳的状态发生了变化,不能说明为氧化还原反应,故B不选;
C.钙元素的化合价在反应前后不变,均为+2价,故C不选;
D.该反应中只有C元素的化合价变化,则碳元素失去了电子,同时也得到了电子,故D选;
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重学生分析能力的考查,注意氧化还原反应的本质为电子转移,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列物质的变化中,有共价键明显被破坏的是( )
| A. | I2升华 | B. | NaCl颗粒被粉碎 | ||
| C. | 溴蒸汽被木炭吸附 | D. | 从NH4HCO3中闻到了刺激性气味 |
2.下列对有关化学反应过程或实验现象的解释正确的是( )
| A. | 工业上用铝制容器盛装浓硫酸,说明常温下铝和浓硫酸不反应 | |
| B. | 在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si | |
| C. | 在空气中加热铝箔,发现内部的铝熔化但不滴落,说明铝不易与氧气反应 | |
| D. | 向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 |
19.下表是元素周期表的一部分,针对a~K十一种元素回答下列问题(请用具体化学式回答,否则不给分)
(1)这些元素中非金属性最强的单质是F2,最高价氧化物对应水化物酸性最强的是HClO4,最高价氧化物对应水化物碱性最强的是NaOH.
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是ACD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)用电子式表示h与k构成化合物的形成过程

(5)写出i的氧化物与强碱溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是ACD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
3.下列实验过程,无明显现象的是( )
| A. | 二氧化硫通入已酸化的硝酸钡溶液 | |
| B. | 二氧化氮通入氯化亚铁溶液中 | |
| C. | 氢氧化铝沉淀中滴加氨水 | |
| D. | 过量铜片与稀硝酸反应结束的溶液中加入稀硫酸 |
20.下列说法正确的是( )
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次升高 | |
| C. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 2-甲基-1,3-丁二烯的键线式为 |
1.当燃烧8.96升由CH4、CO、C2H6组成的混和气体时,除生成水外,还生成17.92升CO2气体(气体体积均在标准状况下测定).则原混和气体中含C2H6的物质的量是( )
| A. | 0.2mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |





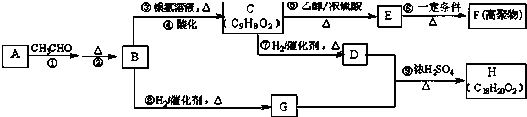
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O
 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$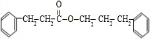 +H2O.
+H2O. .
.