题目内容
7.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )| A. | 向容量瓶中加水未到刻度线 | |
| B. | 所用NaOH已经潮解 | |
| C. | 有少量NaOH溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
分析 结合c=$\frac{n}{V}$可知,不当操作使n偏大或V偏小时,造成所配溶液浓度偏高,以此来解答.
解答 解:A.向容量瓶中加水未到刻度线,V偏小,造成所配溶液浓度偏高,故A选;
B.所用NaOH已经潮解,n偏小,造成所配溶液浓度偏低,故B不选;
C.有少量NaOH溶液残留在烧杯里,n偏小,造成所配溶液浓度偏低,故C不选;
D.用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法,实际NaOH质量为2g-0.4g=2g,n偏小,造成所配溶液浓度偏低,故D不选;
故选A.
点评 本题考查溶液的配制,为高频考点,把握物质的量、体积与浓度的关系为解答的关键,侧重分析与实验能力的考查,注意结合浓度计算公式分析误差,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
| A. | 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在 | |
| B. | 通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在 | |
| C. | 加入BaCl2溶液,生成白色沉淀,加稀硝酸后沉淀不溶解时,可确定有SO42-存在 | |
| D. | 加入NaOH溶液,加热,生成的气体能使干燥的红色石蕊试纸变蓝,可确定有NH4+存在 |
19.室温下,下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Fe3+、NO3-、I- | |
| B. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Al3+、Cl-、SO42- | |
| C. | c( Al 3+)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- |
16.用NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 标准状况下,11.2LH2O所含的分子数为0.5NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+数为0.02NA | |
| D. | 18g H2O和H2O2的混合物含有的分子数为NA |
17.下列分离、提纯、鉴别物质的方法正确的是( )
| A. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| B. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| C. | 用溶解、过滤的方法分离K2MnO4和MnO2固体的混合物 | |
| D. | 用分液的方法分离煤油和汽油 |
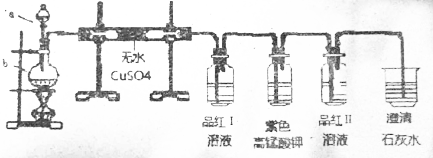
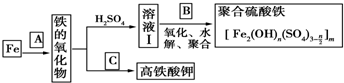
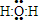 .
.