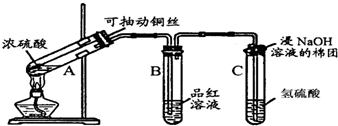
题目内容
17.红热的炭与浓硫酸可发生反应,现设计实验以验证此反应所生成的各种产物.其所使用的试剂次序可表示为:主反应的气体产物→无水硫酸铜→品红Ⅱ→酸性高锰酸钾→品红Ⅱ→澄清石灰水(图)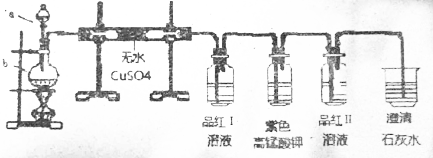
试回答:
(1)写出a仪器名称分液漏斗,b仪器名称圆底烧瓶,写出红热的炭与浓硫酸反应的化学方程式C+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+H2O.
(2)①无水硫酸铜的现象是变蓝,作用是验证产物H2O;
②品红I现象褪色,验证的是产物SO2;
③酸性高锰酸钾现象是褪色,作用是吸收二氧化硫;
④品红Ⅱ现象是无现象,说明二氧化硫已被充分吸收;
③澄清石灰水现象是变浑浊,作用是验证产物CO2.
分析 木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水;验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水;再验证二氧化硫,能使品红试液褪色,再用高锰酸钾除去二氧化硫,并除净后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳,据此回答即可.
解答 解:木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水;验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水;再验证二氧化硫,能使品红试液褪色,再用高锰酸钾除去二氧化硫,并除净后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳.
(1)a仪器名称是分液漏斗,b仪器名称是圆底烧瓶,红热的炭与浓硫酸反应的化学方程式为:C+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+H2O,故答案为:分液漏斗;圆底烧瓶;C+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+H2O;
(2)①验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水;故答案为:变蓝;H2O;
②高锰酸钾能将二氧化硫氧化,但是和二氧化碳不反应,可以用高锰酸钾除去二氧化硫,现象是高锰酸钾褪色,故答案为:褪色;吸收二氧化硫;
③品红Ⅱ用来检验二氧化硫是否除尽,气体通过品红,无现象,说明二氧化硫已被充分吸收,故答案为:无现象;二氧化硫已被充分吸收;
④用澄清石灰验证二氧化碳,二氧化碳能使石灰水变浑浊,故答案为:变浑浊;CO2.
点评 本题考查了浓硫酸性质及其应用,题目难度中等,注意掌握二氧化硫、二氧化碳的性质及检验方法,明确检验顺序为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
13.下列关于化学反应的自发性叙述中正确的是( )
| A. | △H<0且△S>0的反应肯定是不自发的 | B. | △H<0且△S<0的反应肯定是自发的 | ||
| C. | △H>0且△S>0的反应肯定是自发的 | D. | △H<0且△S>0的反应肯定是自发的 |
14.下列说法中正确的是(NA表示阿佛加德罗常数)( )
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 53g碳酸钠中含NA个CO32- | |
| D. | 同温同压下,相同体积的任何气体单质所含的原子数相同 |
2. 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:
NaBr+H2SO4→HBr+NaHSO4
C2H5OH+HBr?C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成,装置如图所示.
实验步骤:
①向A中先加入5mL 95%的无水乙醇(0.085mol)和4.5mL的水,加入溴化钠7.725g,再加入沸石,摇匀.在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中.
②在B中加入9.5mL浓硫酸(0.17mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加入沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g.
回答问题:
(1)仪器E的名称为冷凝管;反应装置中有使用C、D两根温度计,其中D温度计的作用是:D温度计用来测反应体系的温度
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发.饱和亚硫酸氢钠溶液的作用是除去反应中的副产物溴;
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有abd(填标号).
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴;
(4)步骤③中分出馏出液中有机层的操作名称为分液.加入浓硫酸除杂后的溶液明显分层,粗产物在上层(填“上”或“下”);
(5)本实验的产率为64%.
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:NaBr+H2SO4→HBr+NaHSO4
C2H5OH+HBr?C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成,装置如图所示.
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
①向A中先加入5mL 95%的无水乙醇(0.085mol)和4.5mL的水,加入溴化钠7.725g,再加入沸石,摇匀.在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中.
②在B中加入9.5mL浓硫酸(0.17mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加入沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g.
回答问题:
(1)仪器E的名称为冷凝管;反应装置中有使用C、D两根温度计,其中D温度计的作用是:D温度计用来测反应体系的温度
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发.饱和亚硫酸氢钠溶液的作用是除去反应中的副产物溴;
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有abd(填标号).
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴;
(4)步骤③中分出馏出液中有机层的操作名称为分液.加入浓硫酸除杂后的溶液明显分层,粗产物在上层(填“上”或“下”);
(5)本实验的产率为64%.
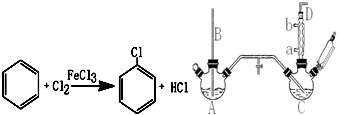
9.氯苯染料、医药工业用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体,橡胶工业用于制造橡胶助剂.其合成工艺分为气相法和液相法两种,实验室模拟液相法(加热装置都已略去)如图,在C三口烧瓶中加入50.0mL苯(含催化剂FeCl3):
有关物质的性质:
回答下列问题:
(1)A反应器是利用实验室法制取氯气,反应原理为(写化学反应方程式):MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置中中空导管B的作用是平衡气压
(2)把干燥的氯气通入装有干燥苯的反应器C中制备氯苯,C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②温度过高,苯挥发,原料利用率不高,D出口的主要尾气成分有Cl2、苯蒸气、HCl.
(3)提纯粗产品过程如下:

①净化过程中加入NaCl晶体的目的是吸水干燥,系列操作为过滤、蒸馏
②为了确定所得产品为氯苯,而非二氯苯,可对产品进行分析,下列方法可行的是AB
A、质谱法 B、红外光谱法 C、滴定法
(4)实验中最终得到产品14.7mL,产率为23.0%,产率不高的原因可能是:温度过高,反应生成二氯苯
(5)苯气相氧氯化氢法制氯苯:空气、氯化氢气混合物温度210℃,进入氯化反应器,在迪肯型催化剂(CuCl2 FeCl3附在三氧化铝上)存在下进行氯化,反应方程式为:2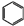 +2HCl+O2$→_{210℃}^{催化剂}$2
+2HCl+O2$→_{210℃}^{催化剂}$2 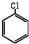 +2 H2O.
+2 H2O.

有关物质的性质:
| 名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
| 苯 | 78 | 78 | 0.88 |
| 氯苯 | 112.5 | 132.2 | 1.1 |
| 邻二氯苯 | 147 | 180.4 | 1.3 |
(1)A反应器是利用实验室法制取氯气,反应原理为(写化学反应方程式):MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置中中空导管B的作用是平衡气压
(2)把干燥的氯气通入装有干燥苯的反应器C中制备氯苯,C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②温度过高,苯挥发,原料利用率不高,D出口的主要尾气成分有Cl2、苯蒸气、HCl.
(3)提纯粗产品过程如下:

①净化过程中加入NaCl晶体的目的是吸水干燥,系列操作为过滤、蒸馏
②为了确定所得产品为氯苯,而非二氯苯,可对产品进行分析,下列方法可行的是AB
A、质谱法 B、红外光谱法 C、滴定法
(4)实验中最终得到产品14.7mL,产率为23.0%,产率不高的原因可能是:温度过高,反应生成二氯苯
(5)苯气相氧氯化氢法制氯苯:空气、氯化氢气混合物温度210℃,进入氯化反应器,在迪肯型催化剂(CuCl2 FeCl3附在三氧化铝上)存在下进行氯化,反应方程式为:2
 +2HCl+O2$→_{210℃}^{催化剂}$2
+2HCl+O2$→_{210℃}^{催化剂}$2  +2 H2O.
+2 H2O.
7.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A. | 向容量瓶中加水未到刻度线 | |
| B. | 所用NaOH已经潮解 | |
| C. | 有少量NaOH溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |