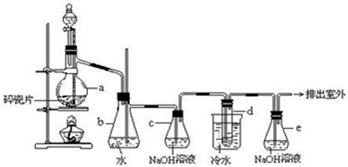
题目内容
18.铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-$\frac{n}{2}$]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品: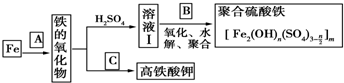
请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:
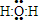 .
.(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O.
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾的化学方程式,并配平:
1Fe2O3+3KNO3+4KOH--2K2FeO4+3KNO2+2H2O
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2
I2+2S2O32-═2I-+S4O62-.
①写出滴定选用的指示剂淀粉,滴定终点观察到的现象溶液由蓝色变无色且保持半分钟不变色.
②溶液Ⅰ中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高(填“偏高”“偏低”或“不变”).
分析 如果A是水,则高温条件下,Fe和水发生反应为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;四氧化三铁和稀硫酸反应生成FeSO4、Fe2(SO4)3;向溶液I中加入B,若B为NaClO3与稀硫酸,发生氧化、水解、聚合反应生成[Fe2(OH)n(SO4)3n/2]m,亚铁离子被氯酸根离子氧化生成铁离子,自身被还原生成氯离子,离子方程式为6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;若C为KNO3和KOH的混合物,其与Fe2O3加热共融制得高铁酸钾(K2FeO4),反应方程式为Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O;
(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气;
(2)溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平;
(3)若C为KKO3和KOH的混合物,与Fe2O3加热共融制得高铁酸钾,则缺项物质为K2FeO4和H2O,根据得失电子相等、质量守恒配平;
(4)①反应原理中有碘单质生成和消耗,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点;
②根据反应2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-找出关系式Fe3+~S2O32-,然后根据关系式计算出铁离子的物质的量,再根据c=$\frac{n}{V}$计算出铁元素含量;根据双氧水对消耗S2O32-的物质的量的影响判断误差.
解答 解:(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,H2O的电子式,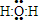 ,
,
故答案为: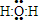 ;
;
(2)根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据化合价升降相等配平,配平后的离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O,
故答案为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
(3)KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则亚铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O,
故答案为:1、3、2、K2FeO4、3、H2O;
(4)①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点,
故答案为:淀粉;溶液由蓝色变无色且保持半分钟不变色;
②由2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-可得:Fe3+~S2O32-,则n(Fe3+)=n(S2O32-)=0.1000mol/L×0.02L=0.002mol,铁元素总含量为:$\frac{56g/mol×0.002mol}{0.02L}$=5.6g/L;
H2O2也能氧化I-生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高,
故答案为:5.6;偏高.
点评 本题考查了物质的制备方案的设计、常见离子的检验、氧化还原反应配平、化学计算等知识,题目难度中等,试题知识点较多、综合性较强,是一道质量结合的题目,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 53g碳酸钠中含NA个CO32- | |
| D. | 同温同压下,相同体积的任何气体单质所含的原子数相同 |
有关物质的性质:
| 名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
| 苯 | 78 | 78 | 0.88 |
| 氯苯 | 112.5 | 132.2 | 1.1 |
| 邻二氯苯 | 147 | 180.4 | 1.3 |
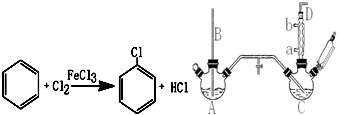
(1)A反应器是利用实验室法制取氯气,反应原理为(写化学反应方程式):MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置中中空导管B的作用是平衡气压
(2)把干燥的氯气通入装有干燥苯的反应器C中制备氯苯,C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②温度过高,苯挥发,原料利用率不高,D出口的主要尾气成分有Cl2、苯蒸气、HCl.
(3)提纯粗产品过程如下:

①净化过程中加入NaCl晶体的目的是吸水干燥,系列操作为过滤、蒸馏
②为了确定所得产品为氯苯,而非二氯苯,可对产品进行分析,下列方法可行的是AB
A、质谱法 B、红外光谱法 C、滴定法
(4)实验中最终得到产品14.7mL,产率为23.0%,产率不高的原因可能是:温度过高,反应生成二氯苯
(5)苯气相氧氯化氢法制氯苯:空气、氯化氢气混合物温度210℃,进入氯化反应器,在迪肯型催化剂(CuCl2 FeCl3附在三氧化铝上)存在下进行氯化,反应方程式为:2
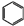 +2HCl+O2$→_{210℃}^{催化剂}$2
+2HCl+O2$→_{210℃}^{催化剂}$2 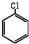 +2 H2O.
+2 H2O. 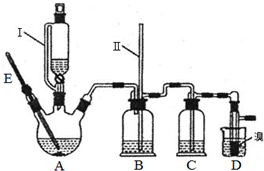 已知:乙醇、1,2-二溴乙烷、乙醚的有关物理性质如下表所示
已知:乙醇、1,2-二溴乙烷、乙醚的有关物理性质如下表所示| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 通常状况下的状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 熔点/℃ | -130 | 9 | -116 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
(1)实验中仪器E的最佳示数为170℃;
加热反应过程中,三颈烧瓶里除生成乙烯外,还可能生成的有机副产物主要是乙醚;
(2)仪器Ⅰ是漏斗,其左部的玻璃管的作用是A(填字母).
A.使漏斗中液体容易滴下
B.有利于吸收气体杂质
C.防止A中三颈烧瓶里的液体爆沸
(3)反应过程中,若B中长玻璃导管(Ⅱ)里的液面上升,则说明可能是由于D中出现堵塞(填“D中出现堵塞”或“C中杂质已除尽”)造成的.
(4)说明制备1,2-二溴乙烷的反应已经结束的实验现象是D中液溴的颜色褪去或D中试管里的液体呈无色;
(5)为验证乙烯具有还原性,可将D装置中的溴换成C(填字母);
A.新制Cu(OH)2悬浊液 B.银氨溶液 C.KMnO4溶液 D.FeCl2溶液
某学生认为若无C除杂,就不能检验乙烯具有还原性,其理由因为乙醇、SO2等具有还原性,也可以使酸性KMnO4溶液褪色.
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2=I2++2Br- | |
| C. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=2Fe3++I2+4Br- | |
| D. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 |
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
| A. | 向容量瓶中加水未到刻度线 | |
| B. | 所用NaOH已经潮解 | |
| C. | 有少量NaOH溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
| A. | 淀粉 | B. | 天然气 | C. | 聚乙烯 | D. | 葡萄糖 |