题目内容
把物质的量浓度均为0.1mol?L-1的HA和B OH溶液等体积混合,下列说法错误的是( )
| A、若HA为弱酸,BOH为弱碱,则有C(H+)+C(B+)═C(OH-)+C(A-) |
| B、若HA为强酸,BOH为弱碱,则有C(A-)>C(B+)>C(H+)>C(OH-) |
| C、若HA为弱酸,BOH为强碱,则有C(B+)>C(A-)>C(OH-)>C(H+) |
| D、若HA为强酸,BOH为强碱,则有C(H+)=C(A-)=C(B+)=C(OH-)=0.1mol?L-1 |
考点:酸碱混合时的定性判断及有关ph的计算,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:A.溶液中一定满足电荷守恒,根据溶液中电荷守恒进行判断;
B.物质的量相同的两溶液恰好反应生成强酸弱碱盐BA,B+部分水解,溶液显示酸性;
C.若HA为弱酸,BOH为强碱,两溶液等体积混合后恰好反应生成强碱弱酸盐BA,A-水解,溶液显示碱性;
D.两溶液等体积混合,生成强酸强碱盐,溶液为中性,溶液中c(A-)、c(B+)减半,即c(A-)=c(B+)=0.05mol/L.
B.物质的量相同的两溶液恰好反应生成强酸弱碱盐BA,B+部分水解,溶液显示酸性;
C.若HA为弱酸,BOH为强碱,两溶液等体积混合后恰好反应生成强碱弱酸盐BA,A-水解,溶液显示碱性;
D.两溶液等体积混合,生成强酸强碱盐,溶液为中性,溶液中c(A-)、c(B+)减半,即c(A-)=c(B+)=0.05mol/L.
解答:
解:A.反应后的溶液中一定满足电荷守恒:c(H+)+c(B+)═c(OH-)+c(A-),故A正确;
B.若HA为强酸,BOH为弱碱,等体积、等浓度的两溶液混合后恰好反应生成强酸弱碱盐BA,由于B+部分水解,溶液显示酸性,则c(A-)>c(B+)、c(H+)>c(OH-),所以溶液中离子浓度大小关系为:c(A-)>c(B+)>c(H+)>c(OH-),故B正确;
C.若HA为弱酸,BOH为强碱,等浓度、等体积的两溶液混合后恰好反应生成强碱弱酸盐BA,由于A-水解,c(B+)>c(A-)、c(OH-)>c(H+),所以溶液中离子浓度关系为:C(B+)>c(A-)>c(OH-)>c(H+),故C正确;
D.HA为强酸,BOH为强碱,二者等体积、等浓度混合后恰好反应生成强酸强碱盐,溶液中c(B+)=c(A-)=0.05mol/L、c(OH-)=c(H+)=10-7mol/L,则溶液中离子浓度关系为:c(B+)=c(A-)=0.05mol/L>c(OH-)=c(H+)=10-7mol/L,故D错误;
故选D.
B.若HA为强酸,BOH为弱碱,等体积、等浓度的两溶液混合后恰好反应生成强酸弱碱盐BA,由于B+部分水解,溶液显示酸性,则c(A-)>c(B+)、c(H+)>c(OH-),所以溶液中离子浓度大小关系为:c(A-)>c(B+)>c(H+)>c(OH-),故B正确;
C.若HA为弱酸,BOH为强碱,等浓度、等体积的两溶液混合后恰好反应生成强碱弱酸盐BA,由于A-水解,c(B+)>c(A-)、c(OH-)>c(H+),所以溶液中离子浓度关系为:C(B+)>c(A-)>c(OH-)>c(H+),故C正确;
D.HA为强酸,BOH为强碱,二者等体积、等浓度混合后恰好反应生成强酸强碱盐,溶液中c(B+)=c(A-)=0.05mol/L、c(OH-)=c(H+)=10-7mol/L,则溶液中离子浓度关系为:c(B+)=c(A-)=0.05mol/L>c(OH-)=c(H+)=10-7mol/L,故D错误;
故选D.
点评:本题考查了酸碱混合定性判断及溶液酸碱性与溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,能够根据电荷守恒、物料守恒、盐的水解原理等知识比较溶液中离子浓度大小.

练习册系列答案
相关题目
下列有关晶体的叙述中,错误的是( )
| A、离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏 |
| B、白磷晶体中,结构粒子之间通过共价键结合 |
| C、石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体 |
| D、构成分子晶体的结构粒子中不一定存在共价键 |
配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏小的是( )
| A、转移溶液后未洗涤烧杯和玻璃棒就直接定容 |
| B、在容量瓶中进行定容时仰视刻度线 |
| C、在容量瓶中定容时俯视刻度线 |
| D、定容后把容量瓶倒转摇匀,发现液面低于刻度 |
以NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
| A、1 L1 mol/L H2SO4,含有2NA个H+ |
| B、500 mL 2 mol/L盐酸比100 mL 2 mol/L硫酸的导电性强 |
| C、1 mol Na2S2,含NA个共价键 |
| D、标准状况下,3.36 LSO2的质量约为9.6g |
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列正确的是( )
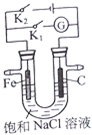

| A、K1闭合,铁棒上发生的反应为2H++2e→H2↑ |
| B、K1闭合,石墨棒周围溶液pH逐渐升高 |
| C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D、K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体 |
下列电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
分类是学习和研究化学的一种常用的科学方法.下列分类合理的是( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱; 同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液.
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱; 同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液.
| A、只有②④ | B、只有②③⑤ |
| C、只有①②④ | D、只有②③⑤ |
氢氧燃料电池已用于航天飞机.关于原电池的叙述正确的是( )
| A、将光能转化为动能 |
| B、将热能转化为机械能 |
| C、将化学能转化为电能 |
| D、燃料电池的能量转化率可达100% |
利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
A、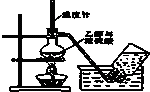 验室制取乙烯 |
B、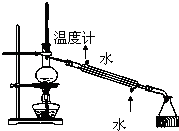 石油的分馏实验 |
C、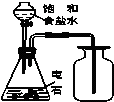 实验室制取乙炔并收集 |
D、 利用酒精萃取碘水中的I2单质 |