题目内容
下列说法中正确的是( )
| A、强电解质溶液的导电能力一定比弱电解质溶液强 |
| B、中和等pH等体积的氨水和NaOH溶液,氨水所需盐酸的物质的量多于NaOH溶液 |
| C、pH相同的FeCl3溶液和HCl溶液,水电离出来的c(H+)相同 |
| D、物质的量浓度相同的磷酸钠溶液和磷酸溶液中所含的c(PO43-)相同 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、溶液的导电性与电解的强弱无关,与离子浓度有关;
B.一水合氨为弱电解质,等pH时,浓度较大;
C、FeCl3溶液对水的电离起促进而盐酸抑制;
D、磷酸钠完全电离,而磷酸第三步电离.
B.一水合氨为弱电解质,等pH时,浓度较大;
C、FeCl3溶液对水的电离起促进而盐酸抑制;
D、磷酸钠完全电离,而磷酸第三步电离.
解答:
解:A、溶液的导电性与电解的强弱无关,与离子浓度有关,故A错误;
B.一水合氨为弱电解质,等pH时,浓度较大,中和时需要盐酸体积较大,故B正确;
C、FeCl3溶液对水的电离起促进而盐酸抑制,所以水电离出来的c(H+)不相同,故C错误;
D、磷酸钠完全电离,而磷酸第三步电离,程度非常微弱,c(PO43-)不相同,故D错误;
故选B.
B.一水合氨为弱电解质,等pH时,浓度较大,中和时需要盐酸体积较大,故B正确;
C、FeCl3溶液对水的电离起促进而盐酸抑制,所以水电离出来的c(H+)不相同,故C错误;
D、磷酸钠完全电离,而磷酸第三步电离,程度非常微弱,c(PO43-)不相同,故D错误;
故选B.
点评:本题考查弱电解质的电离、盐的水解,为高考高频考点,侧重于学生的分析能力和基础知识的理解和应用,难度不大,注意相关基础知识的积累.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
下列关于淀粉、脂肪、蛋白质的说法中错误的是( )
| A、它们都是生活中常见的高分子化合物 |
| B、它们都是有机化合物 |
| C、它们在一定条件下都能发生水解反应 |
| D、它们都是生物体进行生命活动的能源 |
如图由锌-铜-稀H2SO4组成的原电池装置中,当导线中有0.2mol电子通过时,理论上两极的变化是( )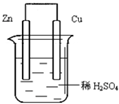

| A、铜片增重6.4g |
| B、锌片增重6.5 g |
| C、铜片上析出0.1 mol O2 |
| D、锌片溶解了6.5 g |
下列各组物质中,前者为强电解质,后者为弱电解质的是( )
| A、碳酸氢钠,醋酸 |
| B、食盐,酒精 |
| C、硫酸,硫酸镁 |
| D、碳酸,碳酸钠 |
下列物质中属于电解质的是( )
| A、Cu |
| B、CuSO4 |
| C、蔗糖 |
| D、酒精 |
下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中有2个π键的是( )
| A、CH2=CH2 |
| B、CO2 |
| C、H2 |
| D、BF3 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L酒精含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.01 NA |
| C、11.2 L H2所含的电子数为NA |
| D、通常状况下,NA个CO2分子含有原子数为3 NA |
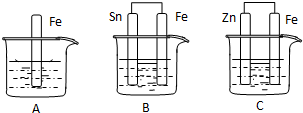 如图所示,烧杯中都盛有稀硫酸.
如图所示,烧杯中都盛有稀硫酸. 某学生利用下面实验装置探究盐桥式原电池的工作原理.
某学生利用下面实验装置探究盐桥式原电池的工作原理.