题目内容
13.二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2.装置如图(有些支持装置省略了)所示.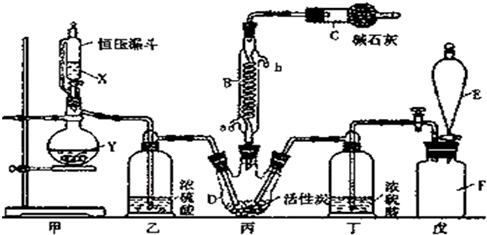
已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体.
(1)E中的试剂是饱和食盐水,戊是贮气装置,则F瓶中气体的实验室制法是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O(用方程式表示);
(2)B处反应管冷却水应从a(填“a”或“b”)接口通入;
(3)装置乙和丁的作用是干燥SO2和Cl2,防止SO2Cl2发生水解反应;
(4)恒压漏斗具有特殊的结构,主要目的是使所加的液体能顺利滴入烧瓶中;
(5)写出二氯化砜(SO2Cl2)水解反应的方程式SO2Cl2+H2O=H2SO4+2HCl;
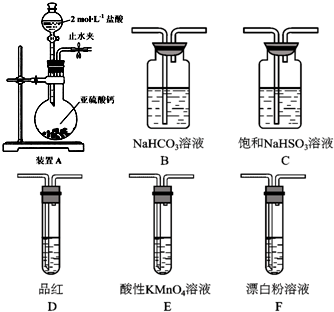
(6)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸,选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:装置连接顺序为A、C、B、E、D、F,其中E的作用是除去除去SO2气体;,通过D中品红不褪色,F中出现白色沉淀现象即可证明亚硫酸的酸性强于次氯酸.
分析 实验室可利用SO2与Cl2反应制取少量的SO2Cl2,则丙中SO2与Cl2反应制取少量的SO2Cl2,甲为制取气体装置,E中的试剂是饱和食盐水,戊是贮气装置,则F装置是除去氯气中的氯化氢,丁中浓硫酸干燥氯气;
甲为制取二氧化硫装置,用亚硫酸钠和浓硫酸制取二氧化硫,乙装置干燥二氧化硫,因为SO2Cl2的熔点为-54.1℃,沸点为69.1℃,所以丙中连接冷凝管,C中碱石灰吸收二氧化硫、氯气,防止污染空气;
(1)F瓶中气体是氯气,实验室用浓盐酸和二氧化锰加热制取氯气;
(2)B处反应管冷却水采用逆流方法;
(3)浓硫酸具有吸水性,能作气体干燥剂;
(4)因为A装置是不连接空气,将生成的气体进入恒压漏斗而产生压力,从而使恒压漏斗中液体流下;
(5)二氯化砜(SO2Cl2)水解生成硫酸和HCl;
(6)次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中.
解答 解:实验室可利用SO2与Cl2反应制取少量的SO2Cl2,则丙中SO2与Cl2反应制取少量的SO2Cl2,甲为制取气体装置,E中的试剂是饱和食盐水,戊是贮气装置,则F装置是除去氯气中的氯化氢,丁中浓硫酸干燥氯气;
甲为制取二氧化硫装置,用亚硫酸钠和浓硫酸制取二氧化硫,乙装置干燥二氧化硫,因为SO2Cl2的熔点为-54.1℃,沸点为69.1℃,所以丙中连接冷凝管,C中碱石灰吸收二氧化硫、氯气,防止污染空气;
(1)F瓶中气体是氯气,实验室用浓盐酸和二氧化锰加热制取氯气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B处反应管冷却水采用逆流方法,则a为进水口、b为出水口,故答案为:a;
(3)浓硫酸具有吸水性,能作气体干燥剂,所以浓硫酸是干燥SO2和 Cl2,防止SO2Cl2发生水解反应,
故答案为:干燥SO2和 Cl2,防止SO2Cl2发生水解反应;
(4)因为A装置是不连接空气,将生成的气体进入恒压漏斗而产生压力,从而使恒压漏斗中液体流下,所以恒压漏斗结构特点目的是使所加的液体能顺利滴入烧瓶中,
故答案为:使所加的液体能顺利滴入烧瓶中;
(5)二氯化砜(SO2Cl2)水解生成硫酸和HCl,反应方程式为SO2Cl2+H2O=H2SO4+2HCl,
故答案为:SO2Cl2+H2O=H2SO4+2HCl;
(6)次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则:装置连接顺序为A、C、B、E、D、F,其中装置E的作用是除去SO2气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸,
故答案为:C、B、E;除去SO2气体;D中品红不褪色,F中出现白色沉淀.
点评 本题考查物质制备及性质实验方案设计,为高频考点,明确实验原理、物质性质是解本题关键,侧重考查学生实验操作、分析评价能力,注意(6)题解答,很多同学往往利用强酸制取弱酸来连接装置而导致错误,注意次氯酸和二氧化硫能发生氧化还原反应,为易错点.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | HNO3、NaCl、K2SO4 | B. | KCl、NaOH、CuSO4 | ||
| C. | BaCl2、NaOH、H2SO4 | D. | FeCl3、Na2SO4、KCl |
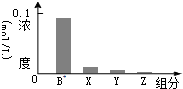 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )| A. | HA为强酸 | B. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | 图中X表示HA,Y表示H+,Z表示OH- | D. | 该混合液pH=7 |
| A. | 非自发的氧化还原反应不可以设计成原电池 | |
| B. | 将反应 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 设计成原电池,其正极反应为:2NO3-+6e-+8H+═2NO+4H2O | |
| C. | 铅蓄电池工作时,正极、负极质量均增加 | |
| D. | 氢氧燃料电池耗H20.1mol时,电路中流经的电子数为0.1NA |
| A. | 人类目前所利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 我国目前最主要的能源是石油 | |
| D. | 能量变化是化学反应的基本特征之一 |
 2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.
2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.