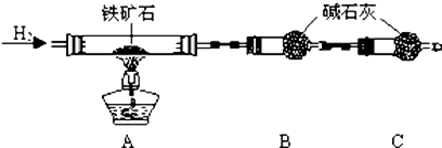
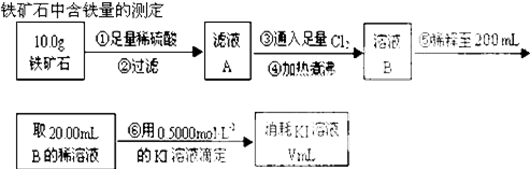
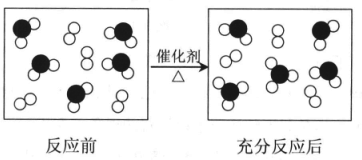
题目内容
8.A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为40,B、W同周期,D、E同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.(1)E元素的盐酸盐或硫酸盐可以用来净水,原理是E元素的盐酸盐或硫酸盐在水中可以水解生成Al(OH)3胶体,Al(OH)3胶体可以吸附水中的悬浮杂质形成沉淀,达到净水的目的(文字表述).
(2)A2W2的分子中所含的化学键为极性共价键、非极性共价键,经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式H2O2?H++HO2-.
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式Cu+2H++H2O2═Cu2++2H2O.
(4)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃,DA能与水反应放氢气,若将1mol DA和1mol E单质混合加入足量的水,充分反应后生成气体的体积是56L(标准状况下).
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+.
(6)在常温下用气体密度测定BW2的相对分子质量,实验值比理论值偏高(填“高”或“低”),其原因是NO2分子相互反应有N2O4生成,物质的量减少.
分析 A、B、W、D、E为短周期元素,且原子序数依次增大,E元素的周期序数与主族序数相等,结合原子序数可知,E只能处于第三周期,故E为Al;D、E同周期,处于第三周期,结合原子序数可知D处于ⅠA族或ⅡA族,而A、D同主族,A、W能形成两种液态化合物A2W和A2W2,A应为H、W为O、D为Na,B的原子序数=40-1-8-11-13=7,则B为N元素,
(1)铝离子水解生成氢氧化铝胶体,吸附悬浮物质;
(2)H2O2分子中含有为极性共价键和非极性共价键;H2O2具有弱酸性,第一步电离产生氢离子与HO2-;
(3)酸性条件下H2O2将Cu氧化为Cu2+,同时生成水;
(4)根据反应NaH+H2O═NaOH+H2↑和2H2O+2NaOH+2Al═2NaAlO2+3H2↑计算;
(5)Na2O2和H2O反应,然后NaOH、O2、Fe2+反应,Na2O2和Fe2+的物质的量之比为1:2,且无气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3;
(6)NO2分子相互反应有N2O4生成,物质的量减少,平均相对分子质量增大.
解答 解:A、B、W、D、E为短周期元素,且原子序数依次增大,E元素的周期序数与主族序数相等,结合原子序数可知,E只能处于第三周期,故E为Al;D、E同周期,处于第三周期,结合原子序数可知D处于ⅠA族或ⅡA族,而A、D同主族,A、W能形成两种液态化合物A2W和A2W2,A应为H、W为O、D为Na,B的原子序数=40-1-8-11-13=7,则B为N元素,
(1)E元素的盐酸盐或硫酸盐在水中可以水解生成Al(OH)3胶体,Al(OH)3胶体可以吸附水中的悬浮杂质形成沉淀,达到净水的目的,
故答案为:E元素的盐酸盐或硫酸盐在水中可以水解生成Al(OH)3胶体,Al(OH)3胶体可以吸附水中的悬浮杂质形成沉淀,达到净水的目的;
(2)H2O2分子中含有为极性共价键和非极性共价键;H2O2具有弱酸性,第一步电离产生氢离子与HO2-,电离方程式为:H2O2?H++HO2-,
故答案为:极性共价键、非极性共价键;H2O2?H++HO2-;
(3)酸性条件下H2O2将Cu氧化为Cu2+,同时生成水,反应离子方程式为:Cu+2H++H2O2═Cu2++2H2O,
故答案为:Cu+2H++H2O2═Cu2++2H2O;
(4)NaH+H2O═NaOH+H2↑
1mol 1mol 1mol
2H2O+2NaOH+2Al═2NaAlO2+3H2↑
1mol 1mol 1.5mol
故生成生成气体的体积=(1mol+1.5mol)×22.4L/mol=56L,
故答案为:56L;
(5)由于Na2O2和Fe2+的物质的量之比为1:2,反应没有气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3,反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+,
故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+;
(6)NO2分子相互反应有N2O4生成,物质的量减少,故平均相对分子质量增大,
故答案为:高;NO2分子相互反应有N2O4生成,物质的量减少.
点评 本题考查结构性质位置关系综合应用,涉及盐类水解、化学键、离子方程式、化学计算等,推断元素是解题关键,侧重对基础知识的应用,难度中等.

| A. | H2、D2和T2互称为同素异形体 | B. | 35Cl和37Cl 互称为同位素 | ||
| C. |  和 和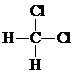 互称为同分异构体 互称为同分异构体 | D. | C2H4与C4H8一定能互称为同系物 |
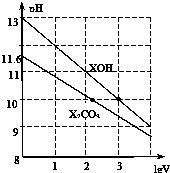 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是强碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1×10-10•2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
请回答下列问题:
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是HF和H2O分子之间能形成氢键.
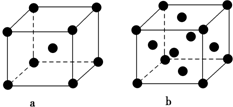
(2)E原子的基态电子排布式为1s22s22p63s23p63d104s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(5)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O,以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有烧杯;滤渣2的主要成分是CoS和NiS;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5 mol•L-1,则应保持溶液中c(S2-)≥1.0×10-6 mol•L-1.
| A. | 该物质一定是钠的化合物 | B. | 该物质一定是金属钠 | ||
| C. | 该物质一定含钠元素 | D. | 可确定该物质中不含钾元素 |