题目内容
8.在密闭容器中,一定量的混合气体发生如下反应:aA(g)+bB(g)?cC(g)+dD (s),平衡时测得A的浓度为0.5mol/L,保持温度不变,将体积压缩为原来的$\frac{1}{2}$,再达到平衡时测得A的浓度为0.8mol/L,则下列说法正确的是( )| A. | 平衡向正反应方向移动 | B. | C的体积分数降低 | ||
| C. | B的转化率降低 | D. | a+b<c+d |
分析 保持温度不变,将容器的体积缩小1倍,如平衡不移动,A气体的浓度为1mol/L,实际A的浓度变为0.8mol/L,说明平衡向正方向移动,据此结合选项解答.
解答 解:保持温度不变,将容器的体积缩小1倍,如平衡不移动,A气体的浓度为1mol/L,实际A的浓度变为0.8mol/L,说明平衡向正方向移动;
A.体积减小即压强增大,平衡向正方向移动,故A正确;
B.平衡向正方向移动,C的体积分数增大,故B错误.
C.平衡向正方向移动,B的转化率升高,故C错误;
D.体积减小,压强增大,平衡向正方向移动,所以正方向是气体系数和减小的方向,D为固体,则a+b>c,故D错误;
故选A.
点评 本题考查学生影响化学平衡移动的因素等方面的知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
2.H+、Na+、Al3+、Ba2+、OH-、HCO3-、Cl-七种离子中的两种可以形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是( )

| A. | 白色沉淀A可能能溶解在溶液D | |
| B. | 在甲中滴加丁可能发生反应:HCO3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 溶液丙与I-、N03-、SO42-可以大量共存 | |
| D. | 溶液甲中一定满足:c(H2CO3)+c(H+)═c(OH-)+c(CO32-) |
3.下列各种说法中正确的是( )
| A. | 凡是能起银镜反应的物质一定是醛 | |
| B. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 酯在过量氢氧化钠溶液中水解生成的最终产物为酸和醇 | |
| D. | 苯酚有弱酸性,因此它是一种羧酸 |
20.下列陈述正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
| D | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| A. | A | B. | B | C. | C | D. | D |
17.普罗帕酮为广谱高效抗心律失常药.下列说法不正确的是( )
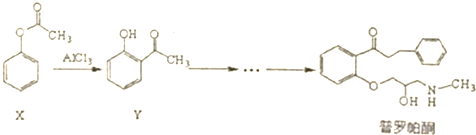

| A. | 普罗帕酮分子中有2个手性碳原子 | |
| B. | 可用溴水或FeCI3溶液鉴别X和Y | |
| C. | 反应物X与中间体Y互为同分异构体 | |
| D. | 普罗帕酮能发生加成、氧化、消去反应 |
18.某化学反应的能量变化示意图如图所示,其中代表反应物的能量减去生成物的是( )


| A. | ① | B. | ② | C. | ③ | D. | ④ |
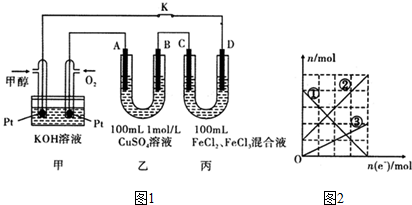
 .
.