题目内容
从矿物学资料查得,一定条件下自然界中有以下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4.下列说法正确的是( )
| A、氧化剂仅是CuSO4,FeS2仅是还原剂 | ||
| B、当生成7molCu2S时,共转移电子14mol | ||
| C、产物中SO42-全部是氧化产物 | ||
D、该反应中1molCuSO4能氧化
|
考点:氧化还原反应
专题:
分析:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价,以此来解答.
解答:
解:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价,
A.CuSO4是氧化剂,FeS2既是还原剂又是还原剂,故A错误;
B.当生成7molCu2S时,由S元素的化合价升高可知,有3mol×[6-(-1)]=21mol e-转移,故B错误;
C.S元素的化合价既升高又降低,由硫酸根离子守恒可知,17个硫酸根离子中有3个SO42-是氧化产物,故C错误;
D.该反应中1molCuSO4能得到1mol电子,1molFeS2失去14mol电子,则1molCuSO4能氧化
mol FeS2,故D错误;
该题无答案.
A.CuSO4是氧化剂,FeS2既是还原剂又是还原剂,故A错误;
B.当生成7molCu2S时,由S元素的化合价升高可知,有3mol×[6-(-1)]=21mol e-转移,故B错误;
C.S元素的化合价既升高又降低,由硫酸根离子守恒可知,17个硫酸根离子中有3个SO42-是氧化产物,故C错误;
D.该反应中1molCuSO4能得到1mol电子,1molFeS2失去14mol电子,则1molCuSO4能氧化
| 1 |
| 14 |
该题无答案.
点评:本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,注意5molFeS2发生反应时只有3molS失去电子,题目难度不大.

练习册系列答案
相关题目
垃圾资源化的方法是( )
| A、填埋 | B、焚烧 |
| C、堆肥 | D、分类回收 |
下列有关原子结构或元素性质说法正确的是( )
| A、原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B、基态碳原子的价电子排布图: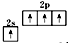 |
C、基态铜原子的价电子排布图: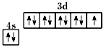 |
| D、Fe3+的最外层电子排布式为:3s23p63d5 |
酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+S03,②2NO+O2=2NO2,③SO3+H2O=H2S04,以下叙述错误的是( )
A、NO2由反应N2+2O2
| ||||
B、总反应可表示为2SO2+2H2O
| ||||
| C、还可能发生的反应有4NO2+O2+2H2O═4HNO3 | ||||
| D、还可能发生的反应有4NO+3O2+2H2O═4HNO3 |
下列叙述中正确的是( )
| A、标准状况下,1 mol任何物质的体积都约为22.4 L |
| B、1 mol任何气体所含分子数都相等,体积也都约为22.4 L |
| C、相同状况下,1 L CO一定比1 L O2的质量小 |
| D、在同温同压下,相同体积的任何气体单质所含原子数目相同 |
设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A、1.0L 0.1 mol?L-1乙酸溶液中,H+离子与CH3COOH分子数目之和约为0.1NA |
| B、pH=2.0的HCl溶液中,水电离产生的H+离子数目为1.0×10-12NA |
| C、1.0L 0.1 mol?L-1乙酸钠溶液中,CH3COO-离子与CH3COOH分子数目之和为0.1NA |
| D、将1.0L pH=2的乙酸溶液加大量水稀释后,溶液中H+离子数目大于0.01 NA |
下列离子方程式正确的是( )
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓SO42- |
| B、H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++=BaSO4↓+H2O |
| C、铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag |
| D、澄清石灰水中加入盐酸 Ca(OH)2+2H+=Ca2++2H2O |
质量相同的两种气体A、B,A的分子数比B多.在同温、同压下,下列说法不正确的( )
| A、A占的体积比B大 |
| B、A的物质的量比B大 |
| C、A的密度比B小 |
| D、A的摩尔质量比B大 |
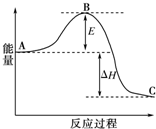 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.