题目内容
3.NA为阿伏加德罗常数的值.下列说法中,正确的是( )| A. | 标准状况下,11.2L HF中含有分子的数目为0.5NA | |
| B. | 常温下21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA | |
| C. | 1 mol-OH与1 molOH-所含电子数均为9 NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
分析 A.标况下HF为液体;
B.C3H6和C4H8的最简式为CH2,根据最简式计算出混合物中含有的碳原子数;
C.1个氢氧根子含有10个电子,1个羟基含有9个电子;
D.过氧化钠和水为歧化反应,过氧化钠既是氧化剂又是还原剂,氧元素的价态由-1价变为0价.
解答 解:A.气体摩尔体积使用对象为气体,标况下HF为液体,不能使用气体摩尔体积,故A错误;
B.常温下,21g C3H6和C4H8的混合物中含有1.5mol最简式CH2,含有1.5molC原子,含有的碳原子数为1.5NA,故B正确;
C.1 mol-OH含有9NA个电子,1 molOH-所含电子数均为10NA,故C错误;
D.过氧化钠和水的反应中,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时,转移0.2NA个电子,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列有关有机化合物结构和性质的说法正确的是( )
| A. | 乙烯、苯和乙酸均能与氢气发生加成反应 | |
| B. | 某芳香烃的分子式为C10H14,常温下它可使酸性KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种 | |
| C. | 1 mol的有机物(结构如图 )最多能与含5mol NaOH的水溶液完全反应 )最多能与含5mol NaOH的水溶液完全反应 | |
| D. | 蛋白质盐析会使蛋白质失去生理活性,加热、紫外线照射等措施可使蛋白质变性 |
3.如图是部分短周期主族元素原子半径与原子序数的关系图,下列说法错误的是( )

| A. | 电解熔融的X与Z构成的化合物可以得到单质Z | |
| B. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| C. | R的单质在过量的O2中燃烧,可得到R的最高价氧化物 | |
| D. | 同周期元素形成的最简单氢化物中,X的沸点最高 |
11.实验室中需要配置2mol/L的NaCl溶液450mL配置时需选用的容量瓶的规格和秤取的NaCl的质量分别是( )
| A. | 450mL 52.65g | B. | 500mL 58.5g | ||
| C. | 500mL 52.65g | D. | 任意规格 58.5g |
8.下列有关实验操作的叙述错误的是( )
| A. | 清洗仪器时,判断洗涤干净的标准是器壁内出现均匀水膜,既不聚成水滴,也不成股流下 | |
| B. | 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 | |
| C. | 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 | |
| D. | 向容量瓶转移液体时,引流用玻璃棒可以接触容量瓶内壁 |
12.下列表示物质变化的化学用语正确的是( )
| A. | 碳酸的电离H2CO3?2H++CO32- | |
| B. | 氯化铁水解Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 硫氢化钠的水解HS-+H2O?S2-+H3O+ | |
| D. | 硫化铝固体在水中不存在Al2S3+6H2O?Al(OH)3+3H2S |
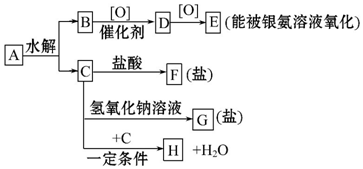
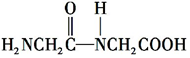 +H2O.
+H2O.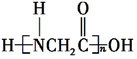 +(n-1)H2O.
+(n-1)H2O.