题目内容
12.已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.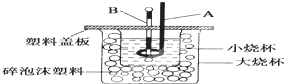
(1)用0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出11.46kJ热量.
(2)如图装置中仪器A的名称是环形玻璃搅拌棒,仪器B的名称是温度计;
(3)若通过实验测定中和热的△H,其结果常常大于-57.3kJ•mol-1,其原因可能是实验过程中难免有热量散失.
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(填“偏大”、“偏小”或“无影响”).
(5)已知氢气与氧气生成1mol液态水放出286kJ热量,则这个反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol.
分析 (1)根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(2)根据常见仪器的用途来解答;
(3)若保温效果不好,有热量散失;
(4)根据弱电解质电离吸热分析;
(5)根据物质的物质的量与热量成正比以及热化学方程式的书写原则书写热化学方程式.
解答 解:(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知生成1molH2O放出热量为57.3kJ,而0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2molH2O,所以放出的热量为57.3kJ×0.2=11.46kJ,
故答案为:11.46;
(2)仪器A的名称是环形玻璃搅拌棒;仪器B的名称是温度计;
故答案为:环形玻璃搅拌棒;温度计;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小,但中和热为负值,所以中和热的△H大于-57.3kJ•mol-1,
故答案为:实验过程中难免有热量散失;
(4)NH3•H2O为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小;
故答案为:偏小;
(5)氢气与氧气生成1mol液态水放出286kJ热量,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol.
点评 本题考查热化学方程式的书写、计算以及测定反应热的误差分析,注意理解中和热的概念,难度中等.

练习册系列答案
相关题目
3.对氮、碳及其化合物的研究具有重要意义.
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=N2O4(g)△H1 K1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2 K2
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=2△H2-△H1 (用△H1、△H2表示),该反应的化学平衡常数K=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$(用K1、K2表示)
(2)汽车尾气转化反应:NO+CO→N2+CO2(未配平),将NO和CO转化为和N2 和CO2,实现除污,每生成1molN2还原剂失去电子数为4×6.02×1023.
(3)大气污染物氮氧化物可以用活性炭还原法处理.某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2 (g).在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
①0~10min内,NO的平均反应速率v(NO)=0.042mol/(L.min);T1℃时,该反应的平衡常数K=$\frac{9}{16}$.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是b(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.恒容时,充入一定量的氦气 d.加入合适的催化剂
(4)氨燃料电池使用的电解质溶液是2mol•L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.放电时,该电池正极的电极反应式为O2+2H2O+4e-=4OH-.
(5)实验室中用NaOH溶液吸收CO2,发生反应为2CO2+3NaOH=Na2CO3+NaHCO3+H2O.所得混合液中所有离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=N2O4(g)△H1 K1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2 K2
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=2△H2-△H1 (用△H1、△H2表示),该反应的化学平衡常数K=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$(用K1、K2表示)
(2)汽车尾气转化反应:NO+CO→N2+CO2(未配平),将NO和CO转化为和N2 和CO2,实现除污,每生成1molN2还原剂失去电子数为4×6.02×1023.
(3)大气污染物氮氧化物可以用活性炭还原法处理.某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2 (g).在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是b(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.恒容时,充入一定量的氦气 d.加入合适的催化剂
(4)氨燃料电池使用的电解质溶液是2mol•L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.放电时,该电池正极的电极反应式为O2+2H2O+4e-=4OH-.
(5)实验室中用NaOH溶液吸收CO2,发生反应为2CO2+3NaOH=Na2CO3+NaHCO3+H2O.所得混合液中所有离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
7.已知下列数据:

实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:
①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;
②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,
③小火加热试管中的混合液;
④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;
⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡.
(2)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(3)步骤③中,用小火加热试管中的混合液,其原因与结论乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(4)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现.
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗,产物应从上口倒出,因为乙酸乙酯比水密度小.
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图Ⅱ甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为哪种装置合理,为什么?
答:乙,反应物能冷凝回流.
| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |

实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:
①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;
②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,
③小火加热试管中的混合液;
④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;
⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡.
(2)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(3)步骤③中,用小火加热试管中的混合液,其原因与结论乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(4)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现.
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗,产物应从上口倒出,因为乙酸乙酯比水密度小.
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图Ⅱ甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为哪种装置合理,为什么?
答:乙,反应物能冷凝回流.
17. 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaCl | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ② |
4.Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸a=7时,HA是强酸;a>7时,HA是弱酸.
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系C.(填字母)
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1.
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-、HB-?H++B2-
(5)在0.1mol•L-1的Na2B溶液中,下列粒子浓度关系式正确的是AC.(填字母)
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
| 实验 编号 | HA物质的量 浓度/(mol•L-1) | NaOH物质的量 浓度/(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系C.(填字母)
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1.
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-、HB-?H++B2-
(5)在0.1mol•L-1的Na2B溶液中,下列粒子浓度关系式正确的是AC.(填字母)
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)





 (注明反应条件),因此,在碱性条件下,由Ⅳ与
(注明反应条件),因此,在碱性条件下,由Ⅳ与 反应生成Ⅱ,其反应类型为取代反应.
反应生成Ⅱ,其反应类型为取代反应.