题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、密封保存的46g NO2气体含有的分子数为NA |
| B、0.1mol/L 碳酸钠溶液中阴离子总数大于0.1NA |
| C、标准状况下,22.4L HF中含有的氟原子数目为NA |
| D、常温常压下,7.1g Cl2与足量的Fe充分反应,转移的电子数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、46g NO2的物质的量为1mol;由于二氧化氮与四氧化二氮存在转化平衡,所以混合气体中含有的分子数小于1mol;
B、没有告诉碳酸钠溶液的体积,无法计算溶液中溶质碳酸钠的物质的量;
C、标准状况下,氟化氢不是气体,题中条件无法计算22.4L氟化氢的物质的量;
D、7.1g氯气的物质的量为0.1mol,0.1mol氯气与铁完全反应转移了0.2mol电子.
B、没有告诉碳酸钠溶液的体积,无法计算溶液中溶质碳酸钠的物质的量;
C、标准状况下,氟化氢不是气体,题中条件无法计算22.4L氟化氢的物质的量;
D、7.1g氯气的物质的量为0.1mol,0.1mol氯气与铁完全反应转移了0.2mol电子.
解答:
解:A、由于二氧化氮与四氧化二氮存在转化平衡,所以混合气体中含有的分子数小于1mol,含有的分子数小于NA,故A错误;
B、没有告诉0.1mol/L 碳酸钠溶液的体积,无法计算溶质碳酸钠的物质的量,故B错误;
C、标况下,氟化氢不是气体,不能使用标况下的气体摩尔体积计算氯化氢的物质的量,故C错误;
D、7.1g氯气的物质的量为0.1mol,0.1mol氯气与题完全反应得到了0.2mol电子,根据电子守恒,转移的电子数目为0.2NA,故D正确;
故选D.
B、没有告诉0.1mol/L 碳酸钠溶液的体积,无法计算溶质碳酸钠的物质的量,故B错误;
C、标况下,氟化氢不是气体,不能使用标况下的气体摩尔体积计算氯化氢的物质的量,故C错误;
D、7.1g氯气的物质的量为0.1mol,0.1mol氯气与题完全反应得到了0.2mol电子,根据电子守恒,转移的电子数目为0.2NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容;注意明确标况下气体摩尔体积的使用条件,选项B为易错点,注意题中数据.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1L0.1mol?L-1乙酸溶液中H+数为0.1NA |
| B、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C、室温下,21.0g乙烯和丙烯的混合气体中含有的碳原子数目为1.5NA |
| D、22.4L的CO气体与lmol N2所含的电子数相等 |
分子式为C5H11Br的一溴代烷水解后的产物在红热铜丝催化,最多可能被空气氧化生成的醛的种数是( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列化学用语或模型表示不正确的是( )
| A、中子数为14的硅原子:1428Si |
B、CH4分子的比例模型 |
C、聚乙烯的结构简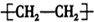 |
| D、次氯酸分子的结构式:H-O-Cl |
下列反应中,属于水解反应且使溶液显酸性的是( )
| A、HSO3-+H2O═H3O++SO32- |
| B、HCO3-+H3O+═CO2↑+2H2O |
| C、S2-+H2O═HS-+OH- |
| D、NH4++H2O═NH3?H2O+H+ |
 如右图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.
如右图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.