题目内容
下列说法正确的是( )
| A、原子间的相互作用叫做化学键 |
| B、第三周期元素的最高正化合价等于它所处的主族序数 |
| C、VIIA 族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D、元素种类由质子数决定,元素原子的化学性质由最外层电子数决定 |
考点:化学键,元素周期表的结构及其应用,元素周期律的作用,原子结构与元素的性质
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A.相邻原子之间强烈的相互作用力称为化学键;
B.第三周期中,元素最高化合价与其族序数相等;
C.第VIIA族元素阴离子的还原性越强,其最高价氧化物的水化物酸性越弱;
D.同一元素的质子数相等,元素的化学性质取决于最外层电子数.
B.第三周期中,元素最高化合价与其族序数相等;
C.第VIIA族元素阴离子的还原性越强,其最高价氧化物的水化物酸性越弱;
D.同一元素的质子数相等,元素的化学性质取决于最外层电子数.
解答:
解:A.相邻原子之间强烈的相互作用力称为化学键,而不是任意原子之间的作用力称为化学键,故A错误;
B.第三周期中,元素最高化合价与其族序数相等,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,所以第VIIA族元素阴离子的还原性越强,其非金属性越弱,则其最高价氧化物的水化物酸性越弱,故C错误;
D.同一元素的质子数或核电荷数相等,所以元素的种类取决于质子数或核电荷数,元素的化学性质取决于最外层电子数,故D正确;
故选BD.
B.第三周期中,元素最高化合价与其族序数相等,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,所以第VIIA族元素阴离子的还原性越强,其非金属性越弱,则其最高价氧化物的水化物酸性越弱,故C错误;
D.同一元素的质子数或核电荷数相等,所以元素的种类取决于质子数或核电荷数,元素的化学性质取决于最外层电子数,故D正确;
故选BD.
点评:本题考查基本概念及基本理论,明确化学键概念、元素周期律等知识点即可解答,注意元素化学性质取决于最外层电子数,题目难度不大.

练习册系列答案
相关题目
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)?2C(g)+D(g) 已达平衡状态的是( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、B的生成速率与D的消耗速率之比为3:1 |
| D、气体的总物质的量 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O.对于该反应,下列说法正确的是( )
| A、该反应是置换反应 |
| B、钾元素化合价降低 |
| C、铁元素化合价不变 |
| D、该反应是氧化还原反应 |
K2O2是一种常见氧化剂、供氧剂,下列说法中正确的是( )
| A、1mol的K2O2中含有3NA个σ键 |
| B、将一定量K2O2是投入含酚酞的水溶液中,反应剧烈,溶液先变红后可能褪色 |
| C、K2O2是一种碱性氧化物 |
| D、1mol K2O2参加的氧化还原反应中,完全转化,转移的电子数一定为2NA |
当0.2molNa2O2足量CO2完全反应后所得固体的质量为( )
| A、21.2g |
| B、21.6g |
| C、22.0g |
| D、22.4g |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、17gNH3所含质子数目为7 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5mol?/L的MgCl2溶液中,含有Cl- 个数为1 NA |
 向20mLAlCl3溶液中滴入2mol?L-1NaOH溶液时,得到Al(OH)3沉淀质量与所滴加NaOH溶液体积关系如右图所示:
向20mLAlCl3溶液中滴入2mol?L-1NaOH溶液时,得到Al(OH)3沉淀质量与所滴加NaOH溶液体积关系如右图所示: 氯气是一种化学性质活泼的气体.
氯气是一种化学性质活泼的气体.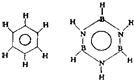 巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )