题目内容
氯气是一种重要的化工原料,在生产和生活中应用十分广泛.
已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气.可供选用的发生装置如图.
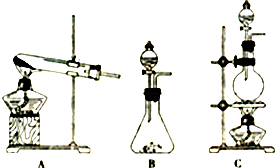
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是 .(选填A或B或C)检查该装置气密性的方法是 .
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的离子方程式: .
(3)实验室收集氯气的方法是 .
(4)常用NaOH溶液吸收氯气防止污染.写出该反应的离子方程式 .
(5)工业上常用氯气和石灰乳反应制漂白粉,请写出该反应的化学方程式 .
已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气.可供选用的发生装置如图.

(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的离子方程式:
(3)实验室收集氯气的方法是
(4)常用NaOH溶液吸收氯气防止污染.写出该反应的离子方程式
(5)工业上常用氯气和石灰乳反应制漂白粉,请写出该反应的化学方程式
考点:氯气的实验室制法
专题:
分析:(1)依据反应物的状态和反应条件选择发生装置,形成一个密闭的系统,检验装置的气密性;
(2)二氧化锰固体和浓盐酸反应生成氯化锰、氯气和水;
(3)依据氯气能溶于水,密度大于空气密度解答;
(4)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水;
(5)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水.
(2)二氧化锰固体和浓盐酸反应生成氯化锰、氯气和水;
(3)依据氯气能溶于水,密度大于空气密度解答;
(4)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水;
(5)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水.
解答:
解:(1)高锰酸钾固体和浓盐酸反应制取氯气,依据高锰酸钾为固体、浓盐酸为液体,反应不需要加热,所以应选择装置B;检查该装置B气密性的方法:
关闭分液漏斗,将导管插入盛有水的烧杯中,用手或者热毛巾捂住锥形瓶,导管口产生气泡,冷却后导管内产生一段稳定的液柱,证明气密性良好;
故答案为:B;关闭分液漏斗,将导管插入盛有水的烧杯中,用手或者热毛巾捂住锥形瓶,导管口产生气泡,冷却后导管内产生一段稳定的液柱,证明气密性良好;
(2)二氧化锰固体和浓盐酸反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(3)氯气能溶于水,密度大于空气密度,所以应选择向上排空气收集;
故答案为:向上排空气;
(4)氯气有毒不能排放到空气中污染环境,用氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,氯化钠、次氯酸钠为易溶于水易电离的盐,所以离子反应为:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(5)工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
关闭分液漏斗,将导管插入盛有水的烧杯中,用手或者热毛巾捂住锥形瓶,导管口产生气泡,冷却后导管内产生一段稳定的液柱,证明气密性良好;
故答案为:B;关闭分液漏斗,将导管插入盛有水的烧杯中,用手或者热毛巾捂住锥形瓶,导管口产生气泡,冷却后导管内产生一段稳定的液柱,证明气密性良好;
(2)二氧化锰固体和浓盐酸反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(3)氯气能溶于水,密度大于空气密度,所以应选择向上排空气收集;
故答案为:向上排空气;
(4)氯气有毒不能排放到空气中污染环境,用氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,氯化钠、次氯酸钠为易溶于水易电离的盐,所以离子反应为:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(5)工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
点评:本题考查了氯气的制取方法和性质的检验,明确氯气制备的原理,熟悉发生装置选择的依据是解题关键,注意离子方程式、化学方程式书写的方法,题目难度不.

练习册系列答案
相关题目
下列关于乙酸的说法不正确的是( )
| A、乙酸分子中含有碳氧双键,所以乙酸能使酸性高锰酸钾溶液褪色 |
| B、乙酸俗称醋酸,无水乙酸又称为冰醋酸,它是纯净物 |
| C、乙酸是重要的有机酸,是一种有刺激性气味的液体 |
| D、可以用乙酸除去热水瓶中的水垢 |
可用于鉴别氯化钾、盐酸、氢氧化钾三种溶液的试剂是( )
| A、AgNO3溶液 |
| B、紫色石蕊试液 |
| C、Na2CO3溶液 |
| D、淀粉碘化钾溶液 |
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-=Cu+H2↑+2H2O+2HCOO-,下列说法错误的是( )
| A、电镀过程中氢气在镀件表面析出 |
| B、电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C、阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D、电镀时每生成6.4g铜,镀层放出2.24L H2 |
为比较盐酸与醋酸的酸性强弱,下列方案不可行的是(均在常温下测定)( )
| A、比较等体积、等pH值的两种溶液的导电性 |
| B、比较等物质的量浓度的氯化钠与醋酸钠溶液的pH值 |
| C、比较等体积、等pH值的两种溶液与过量锌粉反应产生氢气的量 |
| D、比较等体积、等物质的量浓度的两种溶液稀释相同倍数后的pH变化 |
下列有关碳酸钠在化学实验中的作用叙述错误的是( )
| A、用碳酸钠溶液制备少量烧碱 |
| B、用热的碳酸钠溶液洗涤试管内壁的油污 |
| C、用饱和碳酸钠溶液除去CO2中混有的HCl气体 |
| D、用饱和碳酸钠溶液除去乙酸乙酯中混有的乙醇和乙酸 |