题目内容
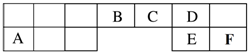
1.有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种.为确定其成分,进行如下实验:(1)取部分溶液,加入适量Na2O2固体,产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;(2)另取部分溶液,加硝酸酸化的Ba(NO3)2溶液,有白色沉淀产生.则此溶液中肯定存在的离子是( )
| A. | K+、HCO3-、MnO4- | B. | Al3+、Mg2+、HCO3- | ||
| C. | Al3+、Mg2+、SO42- | D. | Al3+、Mg2+、NH4+、Cl- |
分析 无色溶液中不含有色离子,则一定不含有色的MnO4-;
(1)取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解,则沉淀的成分是氢氧化镁和氢氧化铝;
(2)取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生,不溶于硝酸的白色沉淀是硫酸钡沉淀,据此来回答问题.
解答 解:无色溶液中不含有色离子,则没有MnO4-;
(1)取部分溶液,加入适量Na2O2固体,过氧化钠先是和水反应生成氢氧化钠和氧气,产生无色无味的气体是氧气,一定不是氨气,故溶液中无NH4+,此时白色沉淀出现,再加入足量的NaOH溶液后白色沉淀部分溶解,则沉淀的成分是氢氧化镁和氢氧化铝,则证明其中一定含有A13+和Mg2+,一定不含有铵根离子、碳酸氢根离子(和铝离子不共存);
(2)取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生,和硫酸根离子反应生成白色不溶于硝酸的白色沉淀是硫酸钡沉淀,证明一定含有SO42-;
根据分析可知肯定有的离子为:A13+、Mg2+、SO42-,
故选C.
点评 本题考查了常见离子的检验方法,题目难度中等,注意明确常见离子的性质及检验的方法,特别是熟悉具有特殊反应现象、颜色的离子,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1molNa与O2在一定条件下生成Na2O和Na2O2混合物时,失去电子数为0.2NA | |
| B. | 50mL 12mol•L-1浓盐酸与足量二氧化锰加热反应,生成Cl2的分子数为0.15NA | |
| C. | 常温下,100mL 1mol•L-1Na2CO3溶液中阴离子总数等于0.1NA | |
| D. | 标准状况下,6.72LCO2中所含的共用电子对数为1.2NA |
12.下列实际应用与水解知识无关的是( )
| A. | 处理锅炉水垢的CaSO4,可先用Na2CO3溶液处理,再用酸去除 | |
| B. | 向TiCl4中加入大量的水,同时加热,可以制备纳米材料制备TiO2 | |
| C. | AlCl3溶液蒸干灼烧得不到AlCl3,而用SOCl2与AlCl3•6H2O混合共热可得无水AlCl3 | |
| D. | 铵态氮肥不可与草木灰同时使用 |
16.25℃时,下列四种溶液中,由水电离生成的氢离子浓度之比①:②:③:④是( )
①1mol•L-1的盐酸 ②0.1mol•L-1的盐酸 ③0.01mol•L-1的NaOH溶液 ④1mol•L-1的NaOH溶液.
①1mol•L-1的盐酸 ②0.1mol•L-1的盐酸 ③0.01mol•L-1的NaOH溶液 ④1mol•L-1的NaOH溶液.
| A. | 1:10:100:1 | B. | 1:10-1:10-12:10-14 | ||
| C. | 14:13:12:14 | D. | 14:13:2:1 |
6.隋唐时的青瓷,胎质坚实,呈青灰色.青瓷的色泽主要取决于氧化亚铁的含量,烧制青瓷的关键在于烧成过程中要掌握好窑炉里的气氛,即要选一定温度下的“还原焰”,“还原焰”中含有一种具有能将氧化铁转化为氧化亚铁的气体物质,该气体物质是( )
| A. | 氧气 | B. | 一氧化碳 | C. | 氮气 | D. | 氯气 |
10.用4种溶液进行实验,如表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液不变浑浊.先通入CO2再通入氨气,溶液变浑浊 | CaCl2溶液 |
| B | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| C | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| D | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.下表是不同温度下水的离子积常数:
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-);.
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀,其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
(4)已知25℃时:
用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解.当加碱调节pH为2.7时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果和原因是Zn2+和Fe2+分离不开,Fe(OH)2和Zn(OH)2的Ksp相近.(lg2=0.3 lg3=0.48)
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-);.
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀,其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
(4)已知25℃时:
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
 是常用洗涤剂的主要成分.
是常用洗涤剂的主要成分.


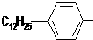 .
.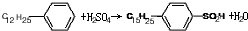 ,反应类型为取代反应.
,反应类型为取代反应.