题目内容
4.镭是周期表中第七周期第ⅡA族元素,下列关于镭的性质描述中,不正确的是( )| A. | 镭比钙的金属性更强 | B. | 单质能与水反应,放出氢气 | ||
| C. | 其氢氧化物呈两性 | D. | 其碳酸盐难溶于水 |
分析 镭是元素周期表中第七周期的ⅡA族元素,最外层有2个电子,性质活泼,易与水反应,利用同主族元素金属性的递变规律分析.
解答 解:A.同主族元素从上到下金属性逐渐增强,镭的金属性较强,镭比钙的金属性强,故C正确;
B.同主族元素从上到下金属性逐渐增强,镭的金属性较强,单质性质活泼,与水反应放出氢气,故B正确;
C.镭比钙的金属性强,所以其氢氧化物呈碱性,故C错误;
D.同主族元素性质相似,碳酸钙不溶于水,则碳酸镭难溶于水,故D正确.
故选C.
点评 本题考查同主族元素的性质的递变规律,从同主族元素金属性对应单质、化合物的性质的相似性和递变性的角度解答该题,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
14.利用如图所示装置模拟电解原理在工业生产上的应用,下列说法正确的是( )
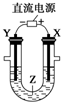

| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的Cu2+浓度不变 | |
| C. | 在铁片上镀铜时,Y是纯铜 | |
| D. | 制取金属镁时,Z是熔融的氯化镁 |
15.下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 0.2 mol•L-1的醋酸(CH3COOH)溶液与0.1 mol•L-1NaOH溶液等体积混合后:c(CH3COO-)+2 c(OH-)=c(CH3COOH)+2c(H+) | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
12.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
9.下列化学式,只能表示一种物质的是( )
| A. | C3H8 | B. | C3H6 | C. | C6H6 | D. | C4H6 |
13.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | 生石灰、氯水、漂白粉 | B. | 烧碱、液氯、食盐水 | ||
| C. | 干冰、食醋、空气 | D. | 盐酸、氮气、胆矾 |
14.某烷烃 的系统命名的名称正确的是( )
的系统命名的名称正确的是( )
 的系统命名的名称正确的是( )
的系统命名的名称正确的是( )| A. | 新戊烷 | B. | 2,2-二甲基丙烷 | C. | 四甲基甲烷 | D. | 2,3-二甲基丙烷 |
